题目内容
3.下列解释实验事实的方程式不准确的是( )| A. | 0.1 mol•L-1 CH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ | |
| B. | “NO2球”浸泡在冷水中,颜色变浅:2NO2(g)??N2O4(g)△H<0 (红棕色) (无色) | |
| C. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO${\;}_{3}^{-}$═3Fe3++2NO↑+4H2O | |
| D. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO${\;}_{3}^{2-}$+H2O?HCO${\;}_{3}^{-}$+OH- |
分析 A、醋酸是弱酸,部分电离;
B、2NO2(g)?N2O4(g)△H<0,降低温度,平衡正向移动;
C、离子方程式遵循电荷守恒和电子守恒;
D、酚酞遇碱变红.
解答 解:A、醋酸是弱酸,部分电离,故0.1mol/L CH3COOH溶液中,c(H+)<0.1mol/L,故pH>1,故A正确;
B、2NO2(g)?N2O4(g)△H<0,降低温度,平衡正向移动,NO2浓度降低,颜色变浅,故B正确;
C、所给离子方程式电荷不守恒,正确的离子方程式应为Fe+4H++HNO3-═Fe3++NO↑+2H2O,故C错误;
D、碳酸是二元弱酸,分步水解,CO32-+H2O?HCO3-+OH-,溶液显碱性,酚酞遇碱变红,故D正确;
故选C.
点评 本题主要考查了电离平衡、化学平衡、水解平衡和硝酸的强氧化性,注意离子方程式的书写是高考不变的一个题型,每年高考必考,是热点题型.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
14.25℃时,0.1mol/L下列溶液的pH如表,有关比较正确的是( )
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | NaCl | CH3COONH4 | NaClO | NaHCO3 | Na2CO3 |
| pH | 7.0 | 7.0 | 10.3 | 8.3 | 11.6 |
| A. | 酸性的相对强弱:HClO>HCO3- | |
| B. | 由水电离产生的c(H+):①=② | |
| C. | 溶液③④中酸根离子浓度:c(ClO-)>c(HCO3-) | |
| D. | 在④⑤溶液等体积混合后的溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol/L |
11.过氧化钠可与CO2作用,反应方程式为2Na2O2+2CO2=2Na2CO3+O2.当0.2mol Na2O2完全作用后,Na2CO3的质量为( )
| A. | 21.2g | B. | 21.6g | C. | 22.0g | D. | 22.4g |
18.在一定温度下,反应$\frac{1}{2}$H2(g)+$\frac{1}{2}$X2(g)?HX(g)的平衡常数为10.若将2.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
| A. | 5% | B. | 25% | C. | 17% | D. | 33% |
8. 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8+26OH--20e-=3CO32-+17H2O;
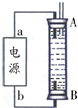
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的正反应为放(填“吸”或“放”)热反应;
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可).
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8+26OH--20e-=3CO32-+17H2O;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可).
15.下列关于电解质说法正确的是( )
| A. | 在熔融状态或溶于水能导电的物质叫电解质 | |
| B. | 电解质在通电时发生电离 | |
| C. | 熔融的KOH导电,所以KOH是电解质 | |
| D. | NaCl晶体不导电,所以NaCl不是电解质 |
12.如表中括号内的物质为所含的少量杂质,请选用最佳的试剂和分离装置将杂
质除去,将对应的编号填入表中.
试剂:a水,b氢氧化钠溶液,c 溴水,d 酸性高
锰酸钾溶液,e生石灰.分离装置:A分液装置,B过滤装置,C蒸馏装置,D洗气装置.
质除去,将对应的编号填入表中.
试剂:a水,b氢氧化钠溶液,c 溴水,d 酸性高
锰酸钾溶液,e生石灰.分离装置:A分液装置,B过滤装置,C蒸馏装置,D洗气装置.
| 需加入的试剂 | 分离装置 | |
| 乙烷(乙烯) | c | D |
| 溴苯(液溴) | b | A |
| 苯(苯酚) | b | A |
| 乙醇(水) | e | C |
13.在标况下,将HCl充满一个干燥烧瓶,将烧瓶倒置于水中,瓶内液面上升,最后烧瓶内溶液的物质的量浓度为:(假设溶质不扩散)( )
| A. | 0.045mol/L | B. | 0.036mol/L | C. | 0.026mol/L | D. | 0.030mol/L |
 在一定条件,可逆反应:mA+nB?pC达到平衡状态.
在一定条件,可逆反应:mA+nB?pC达到平衡状态.