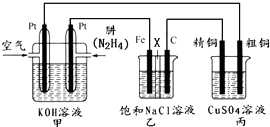
题目内容
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:已知:
①海水中溴元素(以Br-表示)的浓度0.068g/L;
②Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.

(1)请写出一种海水淡化的方法: .
(2)海水中溴离子的物质的量浓度为 .
(3)步骤Ⅰ中已获得低溶度的含Br2溶液,步骤Ⅱ中又将Br2还原为Br-,步骤Ⅲ又得到Br2,其目的为 .
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 .
(5)工业溴提纯可用蒸馏法,蒸馏时加热方法最好采用 ,蒸馏装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 .
①海水中溴元素(以Br-表示)的浓度0.068g/L;
②Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.

(1)请写出一种海水淡化的方法:
(2)海水中溴离子的物质的量浓度为
(3)步骤Ⅰ中已获得低溶度的含Br2溶液,步骤Ⅱ中又将Br2还原为Br-,步骤Ⅲ又得到Br2,其目的为
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为
(5)工业溴提纯可用蒸馏法,蒸馏时加热方法最好采用
考点:海水资源及其综合利用
专题:
分析:海水淡化得到氯化钠、母液、淡水,用氯化钠电解制取氯气,通入母液氧化溴离子为低浓度的溴单质溶液,通入空气吹出溴单质,通入二氧化硫和水溶液吸收得到硫酸和溴化氢,再通入氯气氧化得到溴单质,最后蒸馏得到工业溴;
(1)根据淡化海水的方法分析即可.
(2)海水中溴元素(以Br-表示)的浓度0.068g/L,计算溴元素物质的量得到物质的量浓度;
(3)海水淡化得到的母液和电解氯化钠溶液生成的氯气反应,得到的溴单质浓度低,溴单质在水中有一定的溶解性且和水反应,提取时消耗过的能源和原料,降低了经济效益;
(4)二氧化硫吸收溴单质发生反应生成硫酸和溴化氢;
(5)Br2的沸点为59℃,微溶于水,依据蒸馏操作的依据是控制物质沸点得到;溴单质具有强氧化性,能氧化橡胶管;
(1)根据淡化海水的方法分析即可.
(2)海水中溴元素(以Br-表示)的浓度0.068g/L,计算溴元素物质的量得到物质的量浓度;
(3)海水淡化得到的母液和电解氯化钠溶液生成的氯气反应,得到的溴单质浓度低,溴单质在水中有一定的溶解性且和水反应,提取时消耗过的能源和原料,降低了经济效益;
(4)二氧化硫吸收溴单质发生反应生成硫酸和溴化氢;
(5)Br2的沸点为59℃,微溶于水,依据蒸馏操作的依据是控制物质沸点得到;溴单质具有强氧化性,能氧化橡胶管;
解答:
解:(1)目前淡化海水的方法有多种,如:蒸留法、反渗透法、水合物法、溶剂萃取法和冰冻法;
故答案为:蒸馏法(或电渗析法、离子交换法);
(2)海水中溴元素(以Br-表示)的浓度0.068g/L,计算溴元素物质的量得到物质的量浓度=
=0.00085mol/L;
故答案为:0.00085mol/L;
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,
故答案为:富集溴元素;
(4)二氧化硫吸收溴单质发生反应:Br2+SO2+2H2O═4H++SO42-+2Br-;
故答案为:Br2+SO2+2H2O═4H++SO42-+2Br-;
(5)Br2的沸点为59℃,微溶于水,依据蒸馏操作的依据是控制物质沸点得到;溴单质具有强氧化性,能氧化橡胶管,蒸馏装置中仪器连接均不能用橡胶塞和橡胶管,其原因是Br2腐蚀橡胶;
故答案为:水浴加热,Br2腐蚀橡胶;
故答案为:蒸馏法(或电渗析法、离子交换法);
(2)海水中溴元素(以Br-表示)的浓度0.068g/L,计算溴元素物质的量得到物质的量浓度=
| ||
| 1L |
故答案为:0.00085mol/L;
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,
故答案为:富集溴元素;
(4)二氧化硫吸收溴单质发生反应:Br2+SO2+2H2O═4H++SO42-+2Br-;
故答案为:Br2+SO2+2H2O═4H++SO42-+2Br-;
(5)Br2的沸点为59℃,微溶于水,依据蒸馏操作的依据是控制物质沸点得到;溴单质具有强氧化性,能氧化橡胶管,蒸馏装置中仪器连接均不能用橡胶塞和橡胶管,其原因是Br2腐蚀橡胶;
故答案为:水浴加热,Br2腐蚀橡胶;
点评:本题考查了海水资源的综合利用,涉及到海水提溴工艺,工业流程,氧化还原反应分析判断,实验基本操作的理解应用,难度中等.

练习册系列答案
相关题目
下列物质①SiO2 ②Al2O3③Al(OH)3④Al中既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是( )
| A、③④ | B、②③④ |
| C、①③④ | D、全部 |
下列物质属于纯净物的是( )
| A、玻璃 | B、水玻璃 |
| C、二氧化硅 | D、大理石 |
下列反应的离子方程式书写正确的是( )
| A、二氧化硅与NaOH溶液反应:SiO2+2OH-═SiO32-+H2O | ||||
| B、铜片与浓HNO3反应:Cu+NO3-+2H+═Cu2++NO2↑+H2O | ||||
C、碳酸氢铵与足量NaOH溶液混合后加热:NH4++OH-
| ||||
D、铜片与浓硫酸共热:Cu+4H++SO42-
|
在水中加入等物质的量的MgSO4、NaCl、AgNO3三种物质组成混合溶液,该溶液在惰性材料作电极的电解槽中通电一段时间后,在两个电极区析出的氧化产物与还原产物的质量之比约为( )
| A、35.5:108 |
| B、16:207 |
| C、8:1 |
| D、108:35.5 |
现有两瓶溶液,新制饱和氯水和亚硫酸,下列方法或试剂(必要时可加热):①观察颜色;②石蕊试剂;③品红溶液.能用于鉴别它们的是( )
| A、①②③ | B、只有①③ |
| C、只有②③ | D、只有①② |
图为“长式元素周期表”的一部分,其中短周期元素W、X、Y、Z的位置关系如表.下列说法一定正确的是( )
| X | ||||
| W | Y | Z |
| A、元素Z位于元素周期表的第3周期ⅦA族 |
| B、原子半径的大小顺序为:rY>rW>rX |
| C、元素W的最高价氧化物对应水化物的酸性比Y的强 |
| D、元素X的气态简单氢化物的热稳定性比W的强 |