题目内容
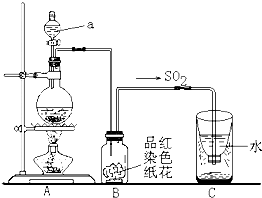
(1)二氧化硫是大气污染物之一,空气中的二氧化硫随雨水下降形成酸雨.某校研究性学习小组利用亚硫酸钠固体与硫酸反应(Na2SO3+H2SO4
| ||
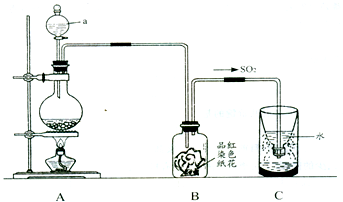
①指出图中仪器a的名称:
②B装置中淡红色纸花的颜色逐渐褪去,说明SO2有
③反应结束后取出C装置中少量液体,滴加紫色石蕊试液后变
④实验完毕后,为了使多余的二氧化硫被充分吸收,C装置应作如何改进?(用文字说明)
(2)查阅资料可知:亚硫酸钠遇空气中的氧气或接触某些氧化剂都会生成硫酸钠;亚硫酸钡
是难溶于水,易溶于酸的白色固体,为证实上述亚硫酸钠已有部分变质,两个小组分别设计方案如下:
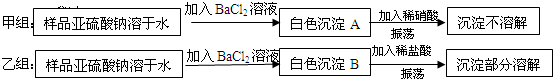
你认为
两组所得到的白色沉淀A、B成分相同,请写出化学式:
分析:(1)①根据仪器名称书写;
②二氧化硫具有漂白性;
③亚硫酸具有酸性,能使酸碱指示剂变色;
④二氧化硫有毒不能直接排空,二氧化硫属于酸性氧化物,能被碱液吸收;
(2)亚硫酸钡能被硝酸氧化生成硫酸钡.
②二氧化硫具有漂白性;
③亚硫酸具有酸性,能使酸碱指示剂变色;
④二氧化硫有毒不能直接排空,二氧化硫属于酸性氧化物,能被碱液吸收;
(2)亚硫酸钡能被硝酸氧化生成硫酸钡.
解答:解:(1)①该仪器是分液漏斗,故答案为:分液漏斗;
②二氧化硫能和品红溶液反应生成无色物质而具有漂白性,所以红花会褪色,故答案为:漂白;
③二氧化硫和水反应生成亚硫酸,亚硫酸电离出氢离子而使亚硫酸溶液具有酸性,酸能使紫色石蕊试液变红色,所以溶液呈红色,故答案为:;
④二氧化硫有毒不能直接排空,二氧化硫属于酸性氧化物,能被碱液吸收生成无毒物质,故答案为:向C中加入过量的氢氧化钠溶液,震荡后静置;
(2)甲组:亚硫酸钠、硫酸钠和氯化钡反应生成BaSO3、BaSO4白色沉淀,亚硫酸钡能被稀硝酸氧化生成硫酸钡,所以最后得到的是硫酸钡;
乙组:亚硫酸钠、硫酸钠和氯化钡反应生成BaSO3、BaSO4白色沉淀,亚硫酸钡和稀盐酸反应生成可溶性的氯化钡,所以最后得到的是硫酸钡沉淀;
所以乙组方案正确,甲组中稀硝酸对反应造成干扰,A、B成分的化学式为BaSO3、BaSO4,
故答案为:乙;亚硫酸钡被硝酸氧化生成硫酸钡;BaSO3、BaSO4.
②二氧化硫能和品红溶液反应生成无色物质而具有漂白性,所以红花会褪色,故答案为:漂白;
③二氧化硫和水反应生成亚硫酸,亚硫酸电离出氢离子而使亚硫酸溶液具有酸性,酸能使紫色石蕊试液变红色,所以溶液呈红色,故答案为:;
④二氧化硫有毒不能直接排空,二氧化硫属于酸性氧化物,能被碱液吸收生成无毒物质,故答案为:向C中加入过量的氢氧化钠溶液,震荡后静置;
(2)甲组:亚硫酸钠、硫酸钠和氯化钡反应生成BaSO3、BaSO4白色沉淀,亚硫酸钡能被稀硝酸氧化生成硫酸钡,所以最后得到的是硫酸钡;
乙组:亚硫酸钠、硫酸钠和氯化钡反应生成BaSO3、BaSO4白色沉淀,亚硫酸钡和稀盐酸反应生成可溶性的氯化钡,所以最后得到的是硫酸钡沉淀;
所以乙组方案正确,甲组中稀硝酸对反应造成干扰,A、B成分的化学式为BaSO3、BaSO4,
故答案为:乙;亚硫酸钡被硝酸氧化生成硫酸钡;BaSO3、BaSO4.
点评:本题考查了二氧化硫的性质、物质的检验等知识点,根据物质间的反应结合反应现象来分析物质的性质,注意(2)中甲组亚硫酸钡能被硝酸氧化而生成硫酸钡造成干扰,为易错点.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
 实验制取乙烯时,应将乙醇和浓硫酸快速加热到170℃,在140℃时会生成乙醚,温度过高会使部分乙醇跟浓H2SO4反应生成SO2、CO2、水蒸气.
实验制取乙烯时,应将乙醇和浓硫酸快速加热到170℃,在140℃时会生成乙醚,温度过高会使部分乙醇跟浓H2SO4反应生成SO2、CO2、水蒸气.