题目内容
16.表是元素周期表的一部分,除标出的元素外,表中的每个编号都代表一种元素,请根据要求回答问题:
(1)元素①的最低价氢化物和最高价氧化物的水化物反应得到一种离子化合物的化学式为NH4NO3;
(2)②和⑥两种元素的原子半径大小关系:②<⑥(填“>”或“<”);
(3)③和⑤两种元素的金属性强弱关系:③>⑤(填“>”或“<”),它们的最高价氧化物对应水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O;
(4)④的单质与⑥的最高价氧化物对应的水化物的稀溶液反应的离子方程式:Mg+2H+=Mg2++H2↑.
分析 由元素的位置可知,①②③④⑤⑥分别为N、O、Na、Mg、Al、S,
(1)①为N元素,元素①的最低价氢化物和最高价氧化物的水化物反应生成硝酸铵;
(2)同主族元素从上到下原子半径增大;
(3)同周期元素从左到右元素的金属性减弱,氢氧化铝为两性氢氧化物;
(4)镁和稀硫酸反应生成硫酸镁和氢气.
解答 解:由元素的位置可知,①②③④⑤⑥分别为N、O、Na、Mg、Al、S,
(1)①为N元素,元素①的最低价氢化物为氨气,和最高价氧化物的水化物硝酸反应生成硝酸铵,化学式为NH4NO3,故答案为:NH4NO3;
(2)同主族元素从上到下原子半径增大,则原子半径②<⑥,故答案为:<;
(3)同周期元素从左到右元素的金属性减弱,则金属性③>⑤,氢氧化铝为两性氢氧化物,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:>;Al(OH)3+OH-=AlO2-+2H2O;
(4)④的单质与⑥的最高价氧化物对应水化物的稀溶液的反应为镁和稀硫酸的反应,反应的离子方程式为Mg+2H+=Mg2++H2↑,
故答案为:Mg+2H+=Mg2++H2↑.
点评 本题考查位置、结构、性质的关系,为高频考点,把握元素的位置推断元素及元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
15.下列物质中,不能使酸性高锰酸钾溶液褪色的是( )
| A. | 苯乙烯 | B. | 乙烯 | C. | 乙醇 | D. | 聚乙烯 |
16.下列实验能达到预期目的是( )
| A. | 用饱和Na2CO3溶液除去SO2气体中含有的少量CO2 | |
| B. | 用加热的方法提取NH4Cl固体中混有的少量单质碘 | |
| C. | 用玻璃棒搅拌漏斗中的液体以加快过滤的速度 | |
| D. | 用醋和KI淀粉溶液检验食用加碘盐中含有的碘元素 |
8.下列说法不正确的是( )
| A. | 用溴水一种试剂可将苯、四氯化碳、己烯、乙醇、苯酚鉴别开 | |
| B. | 组成为 C4H10O 的醇与乙二酸可生成 10 种二元酯 | |
| C. | 含四个碳原子的有机物,氢原子个数一定为 10 个 | |
| D. | 芥子醇(如图)分子中所有碳原子可能在同一平面内,且与足量浓溴水反应最多消耗1molBr2 |
6. 用图所示装置进行下列各组实验,具体操作如下:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图所示装置进行下列各组实验,具体操作如下:将①中溶液滴入②中,预测的现象与实际相符的是( )
 用图所示装置进行下列各组实验,具体操作如下:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图所示装置进行下列各组实验,具体操作如下:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测的实验现象 |
| A | 浓盐酸 | 二氧化锰固体 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 立即产生白色沉淀 |
| D | 稀硫酸 | 滴有石蕊的亚硫酸钠溶液 | 溶液逐渐变红 |
| A. | A | B. | B | C. | C | D. | D |


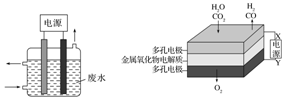 用图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O;
用图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O;