题目内容
 已知前四周期六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大.B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同.请回答下列问题:
已知前四周期六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大.B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同.请回答下列问题:(1)A、B、C、D的第一电离能由小到大的顺序是
(2)化合物BD3的分子空间构型可描述为
(3)已知F元素在人体内含量偏低时,会影响O2在体内的正常运输.已知F2+与KCN溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物.则F的基态原子价电子排布式为
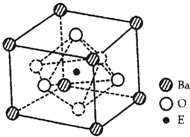
(4)EO2与碳酸钡在熔融状态下反应,所得晶体的晶胞结构如图所示,则该反应的化学方程式为
在该晶体中,E4+的氧配为数为
考点:晶胞的计算,元素电离能、电负性的含义及应用,共价键的形成及共价键的主要类型,判断简单分子或离子的构型,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:根据题目给出的信息推断,B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,故B为P元素;D原子得到一个电子后3p轨道全充满,且原子序数大于P,为Cl元素;A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,分别推断出A为Na、C为S;E4+离子和氩原子的核外电子排布相同,故E为Ti元素;原子序数之和为107,则F为Fe元素.
(1)根据第一电离能递变规律获得答案;
(2)化合物为PCl3,根据价电子对数判断杂化类型和空间构型;
(3)根据Fe元素的原子序数写出价电子排布式;等电子体是指具有相同的原子数和价电子数的原子团;
(4)根据均摊法计算出生成物化学式,写出化学方程式;晶体密度可以通过摩尔质量和摩尔体积计算得出.
(1)根据第一电离能递变规律获得答案;
(2)化合物为PCl3,根据价电子对数判断杂化类型和空间构型;
(3)根据Fe元素的原子序数写出价电子排布式;等电子体是指具有相同的原子数和价电子数的原子团;
(4)根据均摊法计算出生成物化学式,写出化学方程式;晶体密度可以通过摩尔质量和摩尔体积计算得出.
解答:
解:(1)第一电离能同周期从左到右呈增大趋势,其中第ⅤA大于ⅥA,故答案为:Na<S<P<Cl;
(2)PCl3的价电子数=
=4,形成四条新的杂化轨道,价电子数=孤电子对数+配位原子数,即孤电子对数为1,对共价键有排斥作用,故答案为:三角锥形;sp3杂化;
(3)Fe元素的原子序数为26,价电子数为8;CN-的等电子体为有两个原子,且价电子数为10,不难想到N2,根据N2的结构推断π键数,故答案为:3d64s2;N2;2;
(4)晶体中Ba位于顶点,8×
=1,O位于面心6×
=3,Ti位于体心,所以晶体化学式为BaTiO3,根据反应物和生成物可知化学方程式为TiO2+BaCO3=BaTiO3+CO2↑;Ti4+位于体心,与六个位于面心的O邻接;晶胞中含有一个微粒,晶胞体积为(a×10-7)3,Vm=NA×(a×10-7)3,则ρ=
=
,
故答案为:TiO2+BaCO3=BaTiO3+CO2↑;6;
.
(2)PCl3的价电子数=
| 5+3 |
| 2 |
(3)Fe元素的原子序数为26,价电子数为8;CN-的等电子体为有两个原子,且价电子数为10,不难想到N2,根据N2的结构推断π键数,故答案为:3d64s2;N2;2;
(4)晶体中Ba位于顶点,8×
| 1 |
| 8 |
| 1 |
| 2 |
| M |
| Vm |
| 233 |
| NA×(a×10-7)3 |
故答案为:TiO2+BaCO3=BaTiO3+CO2↑;6;
| 233 |
| NA×(a×10-7)3 |
点评:本题考查物质结构与性质,涉及元素周期表、元素周期律、杂化理论、化学键、分子结构与性质、晶胞计算等,难度较大,对学生的思维能力、空间想象能力有一定的要求.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式书写正确的是( )
| A、向稀氨水中通入过量的CO2:2NH3?H2O+CO2═2NH4++H2O+CO32- |
| B、在30mL 1mol?L-1的Na2S03溶液中通入224 mL标准状况下的Cl2:3SO32-+Cl2+H2O=SO42-+2HSO32-+2Cl- |
| C、某钾盐(K2A)的水溶液显碱性,其原因是:A2-+2H2O?H2A+20H- |
| D、在Ba(HCO3)2溶液中逐滴滴入NaHSO4溶液至Ba2+恰好完全沉淀:Ba2++2HCO3-+2H++SO42-═BaSO4↓+2CO2↑+2H2O |
施用化肥和农药有效地促进农作物增产.下列说法不正确的是( )
| A、氨是生产氮肥的重要原料 |
| B、磷肥和钾肥可从无机盐中获得 |
| C、大力推广有机氯、有机磷等有机合成农药 |
| D、开发使用高效、低毒、低残留的第三代环境友好型农药 |
 三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.
 有机化学知识在生活中应用广泛.
有机化学知识在生活中应用广泛.
 能源的开发、利用与人类社会的可持续发展息息相关,充分利用好能源是摆在人类面前的重大课题.
能源的开发、利用与人类社会的可持续发展息息相关,充分利用好能源是摆在人类面前的重大课题.