题目内容
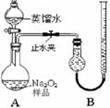
(6分)某工业废水含有Cu2+、Fe3+、 Al3+、Fe2+、Cl-、NO3-、SO42-、SiO32-中的5种,且各种离子的物质的量浓度相等,均为0.1mol/L。为探究废水的组成,甲同学进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液无明显变化。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
(1)由Ⅰ判断,溶液中一定不含有的阳离子是 (写离子符号);
(2)Ⅱ中生成的无色气体是 ,生成无色气体的反应中被氧化的离子是 ;
(3)甲同学最终确定原溶液中所含阳离子是 ,阴离子是 (写离子符号);
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是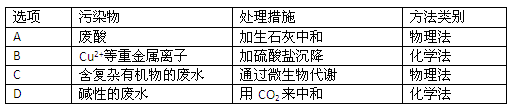
Ⅰ.取少量溶液,加入KSCN溶液无明显变化。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
(1)由Ⅰ判断,溶液中一定不含有的阳离子是 (写离子符号);
(2)Ⅱ中生成的无色气体是 ,生成无色气体的反应中被氧化的离子是 ;
(3)甲同学最终确定原溶液中所含阳离子是 ,阴离子是 (写离子符号);
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是

(6分)(1)Fe3+(1分) (2)NO (1分) Fe2+(1分)
(3)Fe2+、Cu2+,(1分) Cl-、NO3-、SO42- (1分) (4)D (1分)
(3)Fe2+、Cu2+,(1分) Cl-、NO3-、SO42- (1分) (4)D (1分)
试题分析:(1)取少量溶液,加入KSCN溶液无明显变化,说明不存在铁离子,所以由Ⅰ判断,溶液中一定不含有的阳离子是Fe3+。
(2)另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,说明无色气体是NO,因此溶液中硬度含有NO3-。NO3-被还原生成NO,说明一定还还原还原性的离子,因此该离子只能是亚铁离子,即生成无色气体的反应中被氧化的离子Fe2+。
(3)向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成,则白色沉淀应该是硫酸钡,所以一定含有SO42-。又因为各种离子的物质的量浓度相等,均为0.1mol/L,所以根据电荷守恒可知,溶液中还存在的离子应该是铜离子和氯离子,不能含有铝离子,因为无法满足电荷守恒。所以最终确定原溶液中所含阳离子是Fe2+、Cu2+,阴离子是Cl-、NO3-、SO42-。
(4)根据溶液的酸碱性以及离子的性质可知,正确的处理方法是
 。
。点评:该题综合性强,贴近高考,难度较大。该题既有定性的分析,也有大量的计算,增加了试题的难度。有利于培养学生严谨的逻辑推理能力和创新思维能力,有助于提高学生灵活运用基础知识解决实际问题的能力,也有利于培养学生的环境保护意识。

练习册系列答案
相关题目