题目内容
人体内葡萄糖氧化作用可以用以下热化学方程式表示:C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-2 804.6kJ?mol-1.若每人每天需消耗热量12558kJ,则每人每天至少需要葡萄糖多少 g.
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:热化学方程式C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H=-2804.6kJ?mol-1的意义:人体内每摄入葡萄糖180g时,就会放出热量2800.6kJ,据此回答计算.
解答:
解:根据热化学方程式C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-2804.6kJ?mol-1的意义:1mol即180g葡萄糖完全氧化放热2804.6kJ,即180g葡萄糖完全氧化放热2804.6kJ,每人每天需消耗热量12558kJ,则每人每天至少需要葡萄糖的质量是
≈806g,
故答案为:806.
| 12558KJ×180g |
| 2804.6KJ |
故答案为:806.
点评:本题考查有关反应热的计算,明确物质的质量与热量的正比例关系是解答的关键,题目难度不大,属于基础知识的考查.

练习册系列答案
相关题目
下列说法正确的是( )
| A、200ml 1 mol/L Al2(SO4)3溶液中,Al3+和SO42-离子总数为6.02×1023 |
| B、标准状况下11.2L氦气中含有的原子个数为1NA |
| C、46g NO2和N2O4的混合物含有的原子数为3NA |
| D、标准状况下,11.2L苯所含的分子数为0.5 NA |
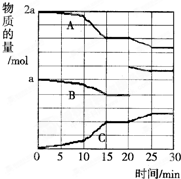 (2)反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是
(2)反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是