题目内容
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,11.2 L氯气所含原子数目为NA |
| B、2 L 0.2 mol/L的K2SO4溶液中K+数目为0.8NA |
| C、1 mol Fe作还原剂可提供电子数为2NA |
| D、标准状况下,NA个CO2分子和NA个H2O分子的体积相同 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、常温常压下,不能使用标况下的气体摩尔体积计算11.2L氯气的物质的量;
B、2 L 0.2 mol/L的K2SO4溶液中含有溶质硫酸钾0.4mol,0.4mol硫酸钾中含有0.8mol钾离子;
C、铁的反应产物中,铁元素的化合价可能为+2、+3价,没有告诉产物,无法判断转移的电子数;
D、标准状况下,水的状态不是气体,不能使用标况下的气体摩尔体积计算水的体积.
B、2 L 0.2 mol/L的K2SO4溶液中含有溶质硫酸钾0.4mol,0.4mol硫酸钾中含有0.8mol钾离子;
C、铁的反应产物中,铁元素的化合价可能为+2、+3价,没有告诉产物,无法判断转移的电子数;
D、标准状况下,水的状态不是气体,不能使用标况下的气体摩尔体积计算水的体积.
解答:
解:A、不是标准状况下,题中条件无法计算11.2L氯气的物质的量,故A错误;
B、该溶液中含有0.4mol溶质硫酸钾,含有0.8mol钾离子,溶液中K+数目为0.8NA,故B正确;
C、铁作还原剂,生成产物可能为铁离子或亚铁离子,题中条件无法计算1mol铁失去的电子数,故C错误;
D、标况下水不是气体,题中条件无法计算水的体积,故D错误;
故选B.
B、该溶液中含有0.4mol溶质硫酸钾,含有0.8mol钾离子,溶液中K+数目为0.8NA,故B正确;
C、铁作还原剂,生成产物可能为铁离子或亚铁离子,题中条件无法计算1mol铁失去的电子数,故C错误;
D、标况下水不是气体,题中条件无法计算水的体积,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数,题目难度中等,注意明确标准状况水不是气体,明确标况下气体摩尔体积的使用条件,掌握阿伏伽德罗常数与物质的量、摩尔质量之间的转化.

练习册系列答案
相关题目
下列实验装置、试剂选用或操作正确的是( )
A、 实验室制乙烯 |
B、 用水吸收氨气 |
C、 稀释浓硫酸 |
D、 海带灼烧成灰 |
已知Ksp(AgC1)=1.8×10-10mol2?L-2,Ksp(AgI)=1.0×1016mo2?L-2.下列说法错误的是( )
| A、AgCl不溶于水,不能转化为AgI | ||||
| B、在含浓度均为0.001mol?L-1的Cl-、I-的溶液中缓慢滴AgNO3稀溶液,先析出AgI | ||||
| C、AgI比AgCl更难溶于水,所以AgCl可转化为AgI | ||||
D、常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于
|
对如图的锌锰电池,下列说法正确的是( )
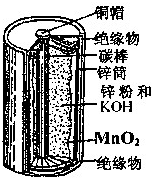

| A、MnO2是氧化剂,被氧化 |
| B、碳棒为负极、锌筒为正极 |
| C、放电过程中NH4+向锌极移动 |
| D、负极反应为:Zn-2e-+2OH-═Zn(OH)2 |
用NA表示阿伏加德罗常数值,下列说法屮正确的是( )
| A、含NA个氧分子的氧气的体积等于22.4L |
| B、Na2O2与H2O反应制O2,每生成1 mol O2转移4NA个电子 |
| C、1mol CH3OH在燃料电池负极发生反应时得到4NA个电子 |
| D、O.O1mol Mg在空气中完全燃烧,生成MgO和Mg3N2,转移电子数是0.02NA |
室温时,在0.1mol?L-1的NH3?H2O溶液中,要促进氨水电离,且氢氧根离子浓度增大,应采取的措施是( )
| A、升温至30℃ |
| B、降温 |
| C、加入NaOH溶液 |
| D、加入稀HCl |