题目内容
某学生设计了以下实验方案,探究铜和一定量(10mL)浓HNO3反应中是否产生NO气体,实验装置如图所示(装置的气密性良好),请回答下列问题: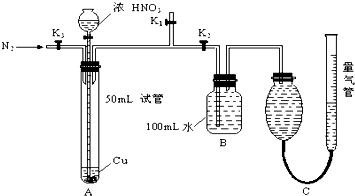
(1)在反应前通入N2的作用是
(2)反应结束后,通过分液漏斗向试管中加40mL蒸馏水,再从B装置所得100mL溶液中取出25.00mL,加2滴酚酞试液,用0.1000mol/L的NaOH溶液滴定,当滴定完成后消耗NaOH溶液18.00mL,则B容器中所得HNO3的物质的量是
(3)用C装置读取排出水的体积时,应注意
(4)若不考虑实验前后导管中的气体,C装置的气体中至少含N2
分析:(1)根据NO的性质分析;由装置图可知N2从K3进,空气从K1排出;
(2)根据硝酸与氢氧化钠反应关系计算;根据二氧化氮与水反应的方程式计算;
(3)读数时要保持左右气体压强相等,以减少误差;
(4)反应结束后,通过分液漏斗向试管中加40mL蒸馏水,已知试管的容积为50ml,所以原来试管内液体为10ml,则试管内的氮气为40ml;C装置测得所收集到的气体体积不等于二氧化氮产生的NO与氮气的体积和.
(2)根据硝酸与氢氧化钠反应关系计算;根据二氧化氮与水反应的方程式计算;
(3)读数时要保持左右气体压强相等,以减少误差;
(4)反应结束后,通过分液漏斗向试管中加40mL蒸馏水,已知试管的容积为50ml,所以原来试管内液体为10ml,则试管内的氮气为40ml;C装置测得所收集到的气体体积不等于二氧化氮产生的NO与氮气的体积和.
解答:解:(1)NO易被空气中的氧气氧化,所以要先用氮气排净装置中的空气;由装置图可知N2从K3进,空气从K1排出,所以要关闭 K2,打开K1、K3;
故答案为:排除装置中的空气,防止生成的NO被氧化;K2;K1、K3;
(2)根据硝酸与氢氧化钠反应的关系:HNO3~NaOH 可知n(HNO3)=0.1000mol/L×0.018L×4=7.2×10-3mol;
由3NO2+H2O=2HNO3+NO可知,n(NO)=
n(HNO3)=3.6×10-3mol,则V(NO)=nVm=3.6×10-3mol×22.4L/mol=0.0806L=80.6ml;
故答案为:7.2×10-3mol;80.6;
(3)读数时要保持左右气体压强相等,以减少误差,即保持两边液面相平,还要用眼睛平视读数;故答案为:保持两边液面相平;眼睛平视读数;
(4)反应结束后,通过分液漏斗向试管中加40mL蒸馏水,已知试管的容积为50ml,所以原来试管内液体为10ml,则试管内的氮气为40ml;C装置测得所收集到的气体体积143.0mL,二氧化氮与水反应产生的NO为80.6ml,氮气的体积为40ml,80.6ml+40ml<143.0mL,说明原来气体中有NO;
故答案为:40mL;有NO生成,NO2溶于水生成7.2×10-3molHNO3的同时,产生80.6mLNO,而试管中原有N2等气体的总体积为40mL,两者加和小于143.0mL.
故答案为:排除装置中的空气,防止生成的NO被氧化;K2;K1、K3;
(2)根据硝酸与氢氧化钠反应的关系:HNO3~NaOH 可知n(HNO3)=0.1000mol/L×0.018L×4=7.2×10-3mol;
由3NO2+H2O=2HNO3+NO可知,n(NO)=
| 1 |
| 2 |
故答案为:7.2×10-3mol;80.6;
(3)读数时要保持左右气体压强相等,以减少误差,即保持两边液面相平,还要用眼睛平视读数;故答案为:保持两边液面相平;眼睛平视读数;
(4)反应结束后,通过分液漏斗向试管中加40mL蒸馏水,已知试管的容积为50ml,所以原来试管内液体为10ml,则试管内的氮气为40ml;C装置测得所收集到的气体体积143.0mL,二氧化氮与水反应产生的NO为80.6ml,氮气的体积为40ml,80.6ml+40ml<143.0mL,说明原来气体中有NO;
故答案为:40mL;有NO生成,NO2溶于水生成7.2×10-3molHNO3的同时,产生80.6mLNO,而试管中原有N2等气体的总体积为40mL,两者加和小于143.0mL.
点评:本题考查了物质性质的分析应用,实验设计的判断,物质反应的计算应用,主要考查及其化合物性质的分析应用,题目难度中等.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
Ⅰ、德国化学家凯库勒认为苯分子的结构中,碳碳间以单、双键交替结合而成环状。为了评价凯库勒的观点,某学生设计了以下实验方案:①按下图所示的装置图连接好各仪器;②检验装置的气密性;③在A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开K1、K2、K3止水夹;④待烧瓶C中气体收集满后,将导管D的下端插入烧杯里的水中,关闭K2,打开K3,挤压预先装有水的胶头滴管的胶头,观察实验现象。

试回答:
(1)写出A中发生反应的化学方程式 ;能证明凯库勒观点错误的实验现象是 ;
(2)装置B的作用是 ;
Ⅱ、用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取烧碱样品5.0g,将样品配成250mL的待测液。
(2)取10.00mL待测液,用 量取注入锥形瓶中。(填仪器)
(3)用0.2000mol/L标准盐酸溶液滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视 ,直到滴定终点。
(4)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度: 。
|
滴定次数 |
待测液体积/mL |
标准盐酸体积/mL |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
10.00 |
0.50 |
20.40 |
|
第二次 |
10.00 |
4.00 |
24.10 |
|
第三次 |
10.00 |
4.20 |
25.70 |
(5)根据上述测定数据,分析得到合理数据,计算烧碱的纯度 。


