题目内容
铁是人类较早使用的金属之一.运用铁的有关知识,回答下列问题:
(1)据有关报道,目前已能冶炼纯度高达99.9999%的铁,关于纯铁的如下叙述中,正确的是
A.硬度比生铁高B.耐腐蚀性强,不易生锈C.不能与盐酸反应D.与不锈钢成分相同E.在冷的浓硫酸中钝化
(2)向沸水中逐滴滴加1mol?L-1 FeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒粒度范围是 .
(3)电子工业需用30%的FeC13溶液腐蚀敷在绝缘板上的铜,制造印刷电路板.请写出FeC13溶液与铜反应的离子方程式 ,检验反应后的溶液中还存在Fe3+的试剂 .
(4)欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①蒸馏水 ②铁粉③浓硝酸④浓盐酸⑤烧碱⑥浓氨水⑦氯气,需要用到的一组试剂是
A.①②④⑦B.①③④⑥C.②④⑤D.①④⑥⑦
(5)若把Fe3O4看成“混合氧化物”时可以写成FeO?Fe2O3,若看成一种盐时又可以写成Fe(FeO2)2.根据化合价规则和这种书写方法,Pb3O4可以分别写作 和 .
(1)据有关报道,目前已能冶炼纯度高达99.9999%的铁,关于纯铁的如下叙述中,正确的是
A.硬度比生铁高B.耐腐蚀性强,不易生锈C.不能与盐酸反应D.与不锈钢成分相同E.在冷的浓硫酸中钝化
(2)向沸水中逐滴滴加1mol?L-1 FeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒粒度范围是
(3)电子工业需用30%的FeC13溶液腐蚀敷在绝缘板上的铜,制造印刷电路板.请写出FeC13溶液与铜反应的离子方程式
(4)欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①蒸馏水 ②铁粉③浓硝酸④浓盐酸⑤烧碱⑥浓氨水⑦氯气,需要用到的一组试剂是
A.①②④⑦B.①③④⑥C.②④⑤D.①④⑥⑦
(5)若把Fe3O4看成“混合氧化物”时可以写成FeO?Fe2O3,若看成一种盐时又可以写成Fe(FeO2)2.根据化合价规则和这种书写方法,Pb3O4可以分别写作
考点:铁的化学性质,铁的氧化物和氢氧化物,铁盐和亚铁盐的相互转变
专题:几种重要的金属及其化合物
分析:(1)铁中含碳越高,硬度越大;越容易形成原电池,发生电化学腐蚀;铁排在氢的前面,可以置换氢;不锈钢除了含有铁外还含有镍铬等元素;浓硫酸具有强的氧化性,常温下能使铁发生钝化;
(2)胶体中分散质粒度介于1-100nm;
(3)三价铁具有强的氧化性,能够氧化铜单质,三氯化铁遇硫氰酸钾显红色;
(4)腐蚀废液中含有氯化铜、氯化亚铁以及氯化铁,铁可以置换金属铜,可以和三价铁反应,铜不能盐酸反应,而金属铁可以,氯气具有氧化性,能将亚铁离子氧化为三价铁;
(5)把氧化物改写成盐的形式时,要把化合价较低的元素作为阳离子,把化合价较高的元素和氧元素组成酸根.
(2)胶体中分散质粒度介于1-100nm;
(3)三价铁具有强的氧化性,能够氧化铜单质,三氯化铁遇硫氰酸钾显红色;
(4)腐蚀废液中含有氯化铜、氯化亚铁以及氯化铁,铁可以置换金属铜,可以和三价铁反应,铜不能盐酸反应,而金属铁可以,氯气具有氧化性,能将亚铁离子氧化为三价铁;
(5)把氧化物改写成盐的形式时,要把化合价较低的元素作为阳离子,把化合价较高的元素和氧元素组成酸根.
解答:
解:(1)A.生铁含碳量高,硬度大于纯铁,故A错误;
B.纯铁难以形成原电池,不能发生电化学腐蚀,所以更耐腐蚀,故B正确;
C.铁能与盐酸反应置换出氢气;
D.不锈钢中出来含铁还含有镍铬等元素,故C错误;
E.浓硫酸具有强的氧化性,常温下能使铁发生钝化,故E正确;
故选:BE;
(2)向沸水中逐滴滴加1mol?L-1 FeCl3溶液,至液体呈透明的红褐色,得到的为氢氧化铁胶体,胶体中分散质粒度介于1-100nm;
故答案为:1-100nm;
(3)三氯化铁与铜反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;三氯化铁遇硫氰酸钾显红色,可以用硫氰酸钾检验三价铁离子的存在;
故答案为:2Fe3++Cu=2Fe2++Cu2+;硫氰酸钾溶液;
(4)腐蚀废液中含有氯化铜、氯化亚铁以及氯化铁,铁可以置换金属铜,可以和三价铁反应,铜不能盐酸反应,而金属铁可以,氯气具有氧化性,能将亚铁离子氧化为三价铁,
故选:A;
(5)将Pb3O4用上述氧化物形式表示,可写成PbO2?2PbO;将Pb3O4看做盐时可以写成Pb2PbO4;
故答案为:PbO2?2PbO;Pb2PbO4.
B.纯铁难以形成原电池,不能发生电化学腐蚀,所以更耐腐蚀,故B正确;
C.铁能与盐酸反应置换出氢气;
D.不锈钢中出来含铁还含有镍铬等元素,故C错误;
E.浓硫酸具有强的氧化性,常温下能使铁发生钝化,故E正确;
故选:BE;
(2)向沸水中逐滴滴加1mol?L-1 FeCl3溶液,至液体呈透明的红褐色,得到的为氢氧化铁胶体,胶体中分散质粒度介于1-100nm;
故答案为:1-100nm;
(3)三氯化铁与铜反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;三氯化铁遇硫氰酸钾显红色,可以用硫氰酸钾检验三价铁离子的存在;
故答案为:2Fe3++Cu=2Fe2++Cu2+;硫氰酸钾溶液;
(4)腐蚀废液中含有氯化铜、氯化亚铁以及氯化铁,铁可以置换金属铜,可以和三价铁反应,铜不能盐酸反应,而金属铁可以,氯气具有氧化性,能将亚铁离子氧化为三价铁,
故选:A;
(5)将Pb3O4用上述氧化物形式表示,可写成PbO2?2PbO;将Pb3O4看做盐时可以写成Pb2PbO4;
故答案为:PbO2?2PbO;Pb2PbO4.
点评:本题考查了铁及化合物的性质,可以根据所学知识进行回答,注意氢氧化铁胶体的制备方法,其难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、无色溶液中:K+、Na+、Cu2+、SO42- |
| B、水电离产生的c(H+)=10-13mol?L-1的溶液中:Na+、Cl-、NO3-、SO42- |
| C、0.1mol?L-1 FeSO4溶液中:K+、NH4+、MnO4-、ClO- |
| D、c(OH-)=10-13mol?L-1的溶液中:Al3+、NO3-、I-、Cl- |
下列物质的类别与所含官能团都正确的是( )
A、 酚类-OH 酚类-OH |
B、 羧酸-COOH 羧酸-COOH |
C、 醛类-CHO 醛类-CHO |
D、CH3-O-CH3醇 |
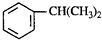 ) ⑧乙炔.按下列要求填空:
) ⑧乙炔.按下列要求填空: 实验室用稀硝酸与铜反应来制备NO气体,如果采用(Ⅰ)装置,实验效果不十分理想,因为从观察到的现象不能有力证明反应产物是NO;有人设计了(Ⅱ)装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意效果.
实验室用稀硝酸与铜反应来制备NO气体,如果采用(Ⅰ)装置,实验效果不十分理想,因为从观察到的现象不能有力证明反应产物是NO;有人设计了(Ⅱ)装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意效果.

 某些石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
某些石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示: