题目内容
9.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16.下列说法错误的是( )| A. | AgCl不溶于水,不能转化为AgI | |
| B. | 在含有浓度均为0.001 mol•L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10-11mol•L-1 |
分析 A.如满足Qc>Ksp,则AgCl能转化为AgI;
B.根据溶解度小的物质先生成沉淀;
C.根据沉淀转化原理分析;
D.根据Ksp(AgCl)求出c(Ag+),再利用Ksp(AgI)求出碘离子的浓度.
解答 解:A.AgCl难溶,但是AgI溶解度更小,所以AgCl能转化为AgI,故A错误;
B.在含浓度均为0.001mol•L-1的Cl-、I-的溶液中缓慢滴AgNO3稀溶液,由于AgI的溶度积小,即溶解度小,所以AgI先形成沉淀析出,故B正确;
C.根据沉淀转化原理:溶解度小的能转化为溶解度更小的,所以AgCl可以转化为AgI,故C正确;
D.已知Ksp(AgCl)=1.8×10-10,则c(Ag+)=$\sqrt{Ksp(AgCl)}$=$\sqrt{1.8×1{0}^{-10}}$,c(I-)=$\frac{Ksp(AgI)}{c(A{g}^{+})}$=$\frac{1.0×1{0}^{-16}}{\sqrt{1.8×1{0}^{-10}}}$=$\frac{1}{\sqrt{1.8}}$×10-11mol,故D正确;
故选:A
点评 本题考查难溶电解质的溶解平衡及沉淀转化的本质,为高频考点,侧重于学生的分析能力和实验能力的考查,注意沉淀转化为溶解度更小的物质容易发生,题目难度不大.

练习册系列答案
相关题目
19.钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.
(1)Al(NO3)3是制备钠硫电池部件的原料之一.由于Al(NO3)3容易吸收环境中的水分,因此需要对其进行定量分析.具体步骤如图所示:

①加入过量氨水后发生反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
②操作b为:过滤.
③Al(NO3)3待测液中,c(Al3+)=$\frac{1000m}{51v}$ mol/L(用含m、V的代数式表示).
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图1所示:

①根据表数据,请你判断该电池工作的适宜应控制在C(填字母)范围内.
A.100℃以下 B.100~300℃C.300~350℃D.350~2050℃
②放电时,电极A为负极,电极B发生还原反应(填“氧化或还原”)
③充电时,总反应为Na2SX═2Na+xS(3<x<5),则阳极的电极反应式为:Sx2--2e-═xS.
(3)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图2所示,槽内的中间用阴离子交换膜隔开.通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.则右侧发生的电极方程式:2H2O+2e-=H2↑+2OH-;试分析左侧溶液蓝色逐渐变浅的可能原因是:右侧溶液中生成的OH-通过阴离子交换膜进入左侧溶液,并与左侧溶液中I2反应.
(1)Al(NO3)3是制备钠硫电池部件的原料之一.由于Al(NO3)3容易吸收环境中的水分,因此需要对其进行定量分析.具体步骤如图所示:

①加入过量氨水后发生反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
②操作b为:过滤.
③Al(NO3)3待测液中,c(Al3+)=$\frac{1000m}{51v}$ mol/L(用含m、V的代数式表示).
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图1所示:

| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050、 |
| 沸点/℃ | 892 | 444.6 | 2980 |
A.100℃以下 B.100~300℃C.300~350℃D.350~2050℃
②放电时,电极A为负极,电极B发生还原反应(填“氧化或还原”)
③充电时,总反应为Na2SX═2Na+xS(3<x<5),则阳极的电极反应式为:Sx2--2e-═xS.
(3)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图2所示,槽内的中间用阴离子交换膜隔开.通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.则右侧发生的电极方程式:2H2O+2e-=H2↑+2OH-;试分析左侧溶液蓝色逐渐变浅的可能原因是:右侧溶液中生成的OH-通过阴离子交换膜进入左侧溶液,并与左侧溶液中I2反应.
14.某校化学兴趣小组采用酸碱中和滴定法测定学校新购入的烧碱的纯度(烧碱中含有不与酸反应的杂质),试根据实验回答.
(1)实验步骤为:①用托盘天平准确称量4.1g烧碱样品.
②将样品配成250ml待测液,需要的仪器除玻璃棒、量筒、烧杯外还需要的玻璃仪器有250ml容量瓶,胶头滴管.
③用碱式滴定管量取10.00ml待测液,注入锥形瓶中.
④在锥形瓶中滴入2~3滴酚酞或甲基橙(填指示剂),用0.2010mol/L的标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色的变化,直到滴定终点.
(2)该小组测得下列数据
根据上述数据,计算烧碱的纯度98%.
(1)实验步骤为:①用托盘天平准确称量4.1g烧碱样品.
②将样品配成250ml待测液,需要的仪器除玻璃棒、量筒、烧杯外还需要的玻璃仪器有250ml容量瓶,胶头滴管.
③用碱式滴定管量取10.00ml待测液,注入锥形瓶中.
④在锥形瓶中滴入2~3滴酚酞或甲基橙(填指示剂),用0.2010mol/L的标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色的变化,直到滴定终点.
(2)该小组测得下列数据
| 滴定次数 | 待测液体积/ml | 标准盐酸体积/ml | |
| 滴定前读数/ml | 滴定后读数/ml | ||
| 第一次 | 10.00 | 0.20 | 22.90 |
| 第二次 | 10.00 | 0.50 | 20.40 |
| 第三次 | 10.00 | 4.00 | 24.10 |
| 第四次 | 10.00 | 0.00 | 20.00 |
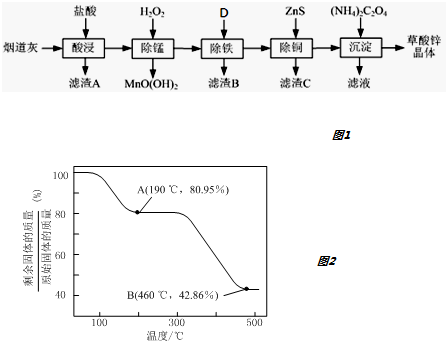
1.以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4•2H2O).如图1
有关氢氧化物开始沉淀和沉淀完全的pH如表:
请问答下列问题:
(1)滤渣A的主要成分为SiO2.为了提高浸出速率,除将烟道灰处理得更细外,还可采取的措施有适当增加盐酸的浓度、提高反应温度、搅拌(写出两条).
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+.
(3)①除铁(部分Cu2+可能被除去)时加入的物质D最好是ZnO或ZnCO3或Zn(OH)2.
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去.
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是将Na2C2O4缓慢加入到ZnCl2溶液中,边加边搅拌.
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如图2所示,300℃~460℃范围内,发生反应的化学方程式为ZnC2O4$\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO↑+CO2↑.

有关氢氧化物开始沉淀和沉淀完全的pH如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
(1)滤渣A的主要成分为SiO2.为了提高浸出速率,除将烟道灰处理得更细外,还可采取的措施有适当增加盐酸的浓度、提高反应温度、搅拌(写出两条).
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+.
(3)①除铁(部分Cu2+可能被除去)时加入的物质D最好是ZnO或ZnCO3或Zn(OH)2.
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去.
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是将Na2C2O4缓慢加入到ZnCl2溶液中,边加边搅拌.
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如图2所示,300℃~460℃范围内,发生反应的化学方程式为ZnC2O4$\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO↑+CO2↑.
18.关于焰色反应实验,说法错误的是( )
| A. | 做焰色反应实验用的铂丝要用受热容易挥发的稀盐酸洗涤 | |
| B. | 观察K2SO4的焰色应透过蓝色的钴玻璃 | |
| C. | 可以用焰色反应来区别NaCl溶液和KCl溶液 | |
| D. | 焰色反应一定是化学变化 |
19.下面有关氧化还原反应的叙述正确的是( )
| A. | 在反应中不一定所有元素的化合价都发生变化 | |
| B. | 肯定有一种元素被氧化,另一种元素被还原 | |
| C. | 非金属单质在反应中只做氧化剂 | |
| D. | 某元素从化合物变为单质时,该元素一定被还原 |

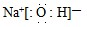 ;
; 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.