题目内容
 (2009?天津)氢氧燃料电池是符合绿色化学理念的新型发电装置.
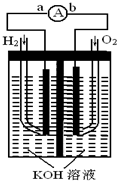
(2009?天津)氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是
由化学能转变为电能
由化学能转变为电能
,在导线中电子流动方向为由a到b
由a到b
(用a、b 表示).(2)负极反应式为
2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O
2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O
.(3)电极表面镀铂粉的原因
增大电极单位面积吸附H2、O2分子数,加快电极反应速率
增大电极单位面积吸附H2、O2分子数,加快电极反应速率
.(4)该电池工作时,H2和O2连续由外部供给,电池可连续
不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2
| ||
Ⅱ.LiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是
Li
Li
,反应Ⅱ中的氧化剂是H2O
H2O
.②已知LiH固体密度约为0.8g/cm3.用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为
8.82×10-4
8.82×10-4
.③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为
32
32
mol.分析:(1)氢氧燃料电池为化学能转化为电能的装置,通入氢气的一极为原电池的负极,发生氧化反应,通入氧气的一极为原电池的正极,发生还原反应,电子由外电路流向正极;
(2)碱性溶液中负极反应为2H2-4e-+4OH-=4H2O,正极反应为O2+4e-+2H2O=4OH-,电池总反应都为2H2+O2=2H2O;
(3)固体的表面积越大,反应速率越大;
(4)①从化合价的变化的角度分析;
②根据反应的电极方程式计算;
③根据实际参加反应的氢气以及电极反应式计算.
(2)碱性溶液中负极反应为2H2-4e-+4OH-=4H2O,正极反应为O2+4e-+2H2O=4OH-,电池总反应都为2H2+O2=2H2O;
(3)固体的表面积越大,反应速率越大;
(4)①从化合价的变化的角度分析;
②根据反应的电极方程式计算;
③根据实际参加反应的氢气以及电极反应式计算.
解答:解:(1)原电池的实质为化学能转化成电能.总反应为2H2+O2=2H2O,其中H2从零价升至+1价,失去电子,即电子从a流向b,
故答案为:由化学能转变为电能;由a到b;
(2)负极为失去电子的一极,即H2失电子生成H+,由于溶液是碱性的,故电极反应式左右应各加上OH-,
负极反应为2H2-4e-+4OH-=4H2O或H2+2OH--2e-=2H2O,故答案为:2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O;
(3)铂粉的接触面积大,可以加快反应速率,
故答案为:增大电极单位面积吸附H2、O2分子数,加快电极反应速率;
(4)①Li从零价升至+1价,作还原剂,H2O的H从+1降至H2中的零价,作氧化剂,故答案为:Li;H2O;
②由反应I,当吸收10molH2时,则生成20molLiH,V=
=
=197.5×10-3L.
=
=8.82×10-4,
故答案为:8.82×10-4;
③20mol LiH可生成20mol H2,实际参加反应的H2为20mol×80%=16mol,1molH2转化成1molH2O,转移2mol电子,所以16molH2可转移32mol的电子,
故答案为:32;
故答案为:由化学能转变为电能;由a到b;
(2)负极为失去电子的一极,即H2失电子生成H+,由于溶液是碱性的,故电极反应式左右应各加上OH-,
负极反应为2H2-4e-+4OH-=4H2O或H2+2OH--2e-=2H2O,故答案为:2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O;
(3)铂粉的接触面积大,可以加快反应速率,
故答案为:增大电极单位面积吸附H2、O2分子数,加快电极反应速率;
(4)①Li从零价升至+1价,作还原剂,H2O的H从+1降至H2中的零价,作氧化剂,故答案为:Li;H2O;
②由反应I,当吸收10molH2时,则生成20molLiH,V=
| m |
| ρ |
| 20×7.9g |
| 0.8×103g/L |
| V(LiH) |
| V(H2) |
| 197.5×10-3L |
| 224L |
故答案为:8.82×10-4;
③20mol LiH可生成20mol H2,实际参加反应的H2为20mol×80%=16mol,1molH2转化成1molH2O,转移2mol电子,所以16molH2可转移32mol的电子,
故答案为:32;
点评:本题考查化学电源的工作原理及有关计算,题目难度较大,注意原电池电极反应式的书写以及从电子守恒的角度计算.

练习册系列答案
相关题目



