题目内容
 甲醇是一种可再生能源,又是一种重要的化工原料,具有开发和应用的广阔前景.工业上可用如下方法合成甲醇:
甲醇是一种可再生能源,又是一种重要的化工原料,具有开发和应用的广阔前景.工业上可用如下方法合成甲醇:| 方法一 | CO(g)+2H2(g)?CH3OH(g) |
| 方法二 | CO2(g)+3H2(g)?CH3OH(g)+H2O(g) |
②2CO(g)+O2(g)?2CO2(g)△H=-566.0kJ?mol-1
③H2O(l)=H2O(g)△H=+44.0kJ?mol-1
则甲醇不完全燃烧生成CO和液态水的热化学反应方程式为
(2)方法一生产甲醇是目前工业上常用的方法.在一定温度下,向2L密闭容器中充入1molCO和2molH2,发生上述反应,5分钟反应达平衡,此时CO的转化率为80%.请回答下列问题:
①前5分钟内甲醇的平均反应速率为
②在该温度下反应的平衡常数K=
③某时刻向该平衡体系中加入CO、H2、CH3OH各0.2mol后,将使ν正
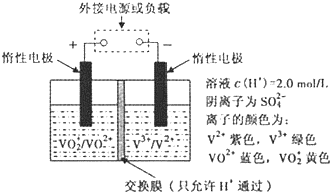
(3)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.
①当左槽溶液逐渐由黄变蓝,其电极反应式为
②充电过程中,右槽溶液颜色变化是
③若用甲醇燃料电池作为电源对其充电时,若消耗甲醇4.8g时,电路中转移的电量的为
考点:化学平衡的计算,用盖斯定律进行有关反应热的计算,原电池和电解池的工作原理
专题:
分析:(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)①反应速率V=
计算得到;自发进行的判断依据△H-T△S<0分析判断;
②依据化学平衡三段式列式计算平衡浓度,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
③依据浓度商和平衡常数比较分析判断反应进行的方向;
(3)①左槽溶液逐渐由黄变蓝,VO2+转变为VO2+,发生还原反应,应为原电池的正极,
②充电过程中,右槽连接电源的负极,发生还原反应,为电解池的阴极,电极反应式为V3++e-=V2+,
③若用甲醇燃料电池作为电源对其充电时,若消耗甲醇4.8g时,物质的量=
=0.15mol,电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,电子转移0.15mol×6=0.9mol,结合法拉第常数计算得到.
(2)①反应速率V=
| △c |
| △t |
②依据化学平衡三段式列式计算平衡浓度,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
③依据浓度商和平衡常数比较分析判断反应进行的方向;
(3)①左槽溶液逐渐由黄变蓝,VO2+转变为VO2+,发生还原反应,应为原电池的正极,
②充电过程中,右槽连接电源的负极,发生还原反应,为电解池的阴极,电极反应式为V3++e-=V2+,
③若用甲醇燃料电池作为电源对其充电时,若消耗甲醇4.8g时,物质的量=
| 4.8g |
| 32g/mol |
解答:
解:(1):①2CH3OH(l)+3O2(g)?2CO2(g)+4H2O(g)△H=-1275.6kJ?mol-1
②2CO(g)+O2(g)?2CO2(g)△H=-566.0kJ?mol-1
③H2O(l)=H2O(g)△H=+44.0kJ?mol-1
由盖斯定律计算,(①-②-③×4)
得到甲醇不完全燃烧生成CO和液态水的热化学反应方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ?mol-1;
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ?mol-1;
(2)在一定温度下,向2L密闭容器中充入1molCO和2molH2,发生上述反应,5分钟反应达平衡,此时CO的转化率为80%,则
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 0.5 1 0
变化量(mol/L) 0.4 0.8 0.4
平衡量(mol/L) 0.1 0.2 0.4
①前5分钟内甲醇的平均反应速率=
=0.08mol/L?min;已知该反应在低温下能自发进行,△H-T△S<0,反应△S<0,则△H<0;
故答案为:0.08mol/(L?min);<;
②K=
=100,故答案为:100;
③某时刻向该平衡体系中加入CO、H2、CH3OH各0.2mol后,浓度商Q=
=25<100,反应正向进行,V正>V逆,故答案为:>;
(3)①当左槽溶液逐渐由黄变蓝,其电极反应式为VO2++2H++e-=VO2++H2O,说明此时为原电池,且为原电池的正极,故答案为:VO2++2H++e-=VO2++H2O;
②充电过程中,右槽连接的是电源负极,为电解池的阴极,电极反应式为V3++e-=V2+,V3+为绿色,V2+为紫色,故可以看到右槽溶液颜色逐渐由绿色变为紫色.
故答案为:由绿色变为紫色;
③若用甲醇燃料电池作为电源对其充电时,若消耗甲醇4.8g时,物质的量=
=0.15mol,电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,电子转移0.15mol×6=0.9mol,电路中转移的电量的=9.65×l04C?mol-1 ×0.9mol=8.685×104C,
故答案为:8.685×104C.
②2CO(g)+O2(g)?2CO2(g)△H=-566.0kJ?mol-1
③H2O(l)=H2O(g)△H=+44.0kJ?mol-1
由盖斯定律计算,(①-②-③×4)
| 1 |
| 2 |
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ?mol-1;
(2)在一定温度下,向2L密闭容器中充入1molCO和2molH2,发生上述反应,5分钟反应达平衡,此时CO的转化率为80%,则
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 0.5 1 0
变化量(mol/L) 0.4 0.8 0.4
平衡量(mol/L) 0.1 0.2 0.4
①前5分钟内甲醇的平均反应速率=
| 0.4mol/L |
| 5min |
故答案为:0.08mol/(L?min);<;
②K=
| 0.4 |
| 0.1×0.22 |
③某时刻向该平衡体系中加入CO、H2、CH3OH各0.2mol后,浓度商Q=
| 0.2 |
| 0.2×0.22 |
(3)①当左槽溶液逐渐由黄变蓝,其电极反应式为VO2++2H++e-=VO2++H2O,说明此时为原电池,且为原电池的正极,故答案为:VO2++2H++e-=VO2++H2O;
②充电过程中,右槽连接的是电源负极,为电解池的阴极,电极反应式为V3++e-=V2+,V3+为绿色,V2+为紫色,故可以看到右槽溶液颜色逐渐由绿色变为紫色.
故答案为:由绿色变为紫色;
③若用甲醇燃料电池作为电源对其充电时,若消耗甲醇4.8g时,物质的量=
| 4.8g |
| 32g/mol |
故答案为:8.685×104C.
点评:本题考查了热化学方程式书写方法,化学平衡影响因素分析,平衡计算理解应用,平衡常数、反应速率概念的计算分析,电解池中,与电源正极相连为阳极,发生氧化反应,失去电子,与电源负极相连的阴极,发生还原反应,得到电子,并且根据得失电子守恒计算,题目难度中等.

练习册系列答案
相关题目
下列物质中,可用于治疗胃酸过多的是( )
| A、碳酸氢钠 | B、氢氧化钠 |
| C、氧化钠 | D、碳酸钡 |
下列各组离子在指定条件下一定能大量共存的是( )
| A、含新制氯水的溶液中:H+、Fe2+、Cl-、SO42- |
| B、滴入酚酞显红色的溶液中:NH4+、Mg2+、AlO2-、NO3- |
| C、澄清透明的溶液中:Cu2+、K+、NO3-、Cl- |
| D、加入铝粉产生氢气的溶液中:Fe3+、Al3+、Cl-、CO32- |
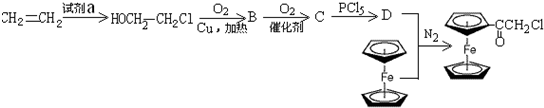
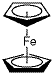 I.二茂铁(如图)是一种具有芳香族性质的有机过渡金属化合物,易燃,不溶于水,易溶于苯、乙醚、汽油柴油等有机溶剂.制备二茂铁需要有机物A.元素分析表明:A中只含有C、H两种元素.红外光谱测得:A分子中含有双键,没有侧链,具有环状结构.1H核磁共振谱分析:A分子中有3种不同化学环境的氢原子,其个数比为1:1:1.
I.二茂铁(如图)是一种具有芳香族性质的有机过渡金属化合物,易燃,不溶于水,易溶于苯、乙醚、汽油柴油等有机溶剂.制备二茂铁需要有机物A.元素分析表明:A中只含有C、H两种元素.红外光谱测得:A分子中含有双键,没有侧链,具有环状结构.1H核磁共振谱分析:A分子中有3种不同化学环境的氢原子,其个数比为1:1:1.