题目内容
16.下列反应中,SO2做还原剂的是( )| A. | 2Mg+SO2$\frac{\underline{\;△\;}}{\;}$2MgO+S | |
| B. | SO2+Br2+2H2O═2HBr+H2SO4 | |
| C. | Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O | |
| D. | SO2+2NaOH═Na2SO3+H2O |
分析 SO2做还原剂,则S失去电子,元素的化合价升高,以此来解答.
解答 解:A.S元素的化合价降低,则二氧化硫为氧化剂,故A不选;
B.S元素的化合价升高,SO2做还原剂,故B选;
C.二氧化硫为生成物,为还原产物,故C不选;
D.不存在元素的化合价变化,为非氧化还原反应,故D不选;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意还原剂的判断,题目难度不大.

练习册系列答案
相关题目
7.按照物质的树状分类和交叉分类,氯水应属于( )
①酸 ②能导电 ③胶体 ④混合物 ⑤化合物 ⑥溶液 ⑦电解质.
①酸 ②能导电 ③胶体 ④混合物 ⑤化合物 ⑥溶液 ⑦电解质.
| A. | ①②④⑥⑦ | B. | ①②⑤⑦ | C. | ②④⑥ | D. | ②④⑥⑦ |
4. 已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
请根据信息回答有关问题:
(1)写出元素Y的原子核外价电子排布图: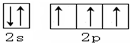 .X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.
.X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号)N>O>C.
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式)H2O,原因是水分子间可以形成氢键,使沸点升高.
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式:C≡O.
(5)R的一种配合物的化学式为RCl3•6H2O.已知0.01mol RCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2OD.[R(H2O)3Cl3]•3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,继续滴加氨水至过量,沉淀溶解,
得到天蓝色溶液,写反应的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
(7)元素E的单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.
若已知该元素的原子半径为d cm,相对原子质量为M,NA代表阿伏加德罗常数,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).
 已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数 |
| Y | 原子核外的L层有3个未成对电子 |
| Z | 地壳中含量最多的元素 |
| Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | N能层上只有一个电子,K、L、M层均排满电子 |
(1)写出元素Y的原子核外价电子排布图:
 .X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.
.X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号)N>O>C.
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式)H2O,原因是水分子间可以形成氢键,使沸点升高.
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式:C≡O.
(5)R的一种配合物的化学式为RCl3•6H2O.已知0.01mol RCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2OD.[R(H2O)3Cl3]•3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,继续滴加氨水至过量,沉淀溶解,
得到天蓝色溶液,写反应的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
(7)元素E的单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.
若已知该元素的原子半径为d cm,相对原子质量为M,NA代表阿伏加德罗常数,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).
11.蛇纹石由MgO、Al2O3、SiO2、Fe2O3组成.现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量.下列叙述正确的是( )
| A. | 沉淀X的成分是SiO2 | |
| B. | 将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3 | |
| C. | 在溶液Y中加入过量的NaOH溶液,过滤得到沉淀是Fe(OH)3 | |
| D. | 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+ |
1.五种短周期元素在元素周期表中的位置如表所示,其中X元素最高正化合价与最低负化合价的代数和为0,下列判断不正确的是( )
| X | |||||
| Z | Y | M | N |
| A. | N的氧化物对应水化物的酸性一定比X的氧化物对应水化物的酸性强 | |
| B. | 相同条件下,与同浓度、同体积的盐酸反应,单质Z的反应速率大于单质Y | |
| C. | X的原子半径比Y的小 | |
| D. | X和M的原子序数相差10 |
8.下列分类标准和分类结果不对应的是( )
| 选项 | 分类标准 | 分类结果 |
| A | 根据化学反应中有无单质参加或生成 | 氧化还原反应和非氧化还原反应 |
| B | 根据化学反应中有无离子参加或生成 | 离子反应和非离子反应 |
| C | 根据混合物中分散质粒子直径的大小 | 胶体、溶液和浊液 |
| D | 根据无机化合物的组成和性质特点 | 酸、碱、盐、氧化物等 |
| A. | A | B. | B | C. | C | D. | D |
14.下列实验操作与预期实验目的或所得实验结论不一致的是( )
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将Al2(SO4)2、NaOH溶液相互滴加 | 鉴别Al2(SO4)3、NaOH溶液 |
| B | 向某溶液中滴加氯水,再滴加KSCN溶液,溶液变成红色 | 该溶液中一定含有Fe2+ |
| C | 向NaHS溶液中滴入酚酞,溶液变红色 | HS-水解程度大于电离程度 |
| D | 向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液,均有沉淀 | 蛋白质均发生了变性 |
| A. | A | B. | B | C. | C | D. | D |
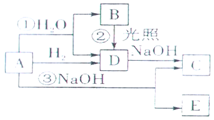 A是黄绿色气体单质,如图所示,
A是黄绿色气体单质,如图所示,