题目内容
8.请按要求完成下列问题:(1)写出基态Fe的电子排布式和Mg2+的轨道表示式1s22s22p63s23p63d64s2或[Ar]3d64s2、
 .
.(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:Co3+、CN-、6.
(3)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角平面正三角形、sp2、120°.
(4)若Pt(NH3)2Cl2分子是平面结构,请画出Pt(NH3)2Cl2可能的结构简式
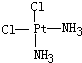 、
、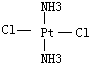 .
.(5)下列分子中若有手性分子,请用“*”标出其手性碳原子.
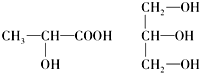
分析 (1)根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写;
(2)配合物中含有空轨道的金属阳离子为中心离子,有孤对电子的原子或离子为配体,配位数就是配体的个数;
(3)计算BCl3分子的中心原子B的价层电子对数,确定VSEPR模型和空间构型,杂化轨道数目和类型、根据空间构性确定键角;
(4)Pt(NH3)2Cl2分子是平面结构,两个Cl原子有相邻和相对两种位置;
(5)连接4个不同原子或原子团的碳原子为手性碳原子.
解答 解:(1)Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2或[Ar]3d64s2,Mg2+含有的核外电子数为12-2=10个,核外电子排布式为1s22s22p6,电子排布图为 ,
,
故答案为:1s22s22p63s23p63d64s2或[Ar]3d64s2; ;
;
(2)根据配合物K3[Co(CN)6]结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Co3+、有孤对电子的原子或离子为配体,所以配体为CN-、配位数就是配体的个数,所以配位数为6,
故答案为:Co3+;CN-;6;
(3)BCl3分子的中心原子B的价层电子对数=3+$\frac{1}{2}$(3-3×1)=3,孤电子对数为0,因此空间构型和VSEPR模型一致,为平面正三角形,因此键角为120°,杂化类型为sp2杂化,
故答案为:平面正三角形;sp2;120°;
(4)Pt(NH3)2Cl2分子是平面结构,两个Cl原子有相邻和相对两种位置,故答案为: 、
、 ;
;
(5)手性碳原子连接四个不同的原子或原子团,前者有手性碳原子,后者没有,故答案为: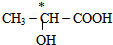 .
.
点评 本题考查了核外电子排布式(图)、配合物和分子结构、杂化等知识,题目难度中等,熟练掌握原子核外电子排布规律、价层电子对互斥理论和轨道杂化理论是解题的关键.

| A. | B的平均消耗速率为0.3mol/(L•min) | |
| B. | 升高温度时,v正减小,v逆增大 | |
| C. | 若单位时间内生成的B和D的物质的量之比为3:1,则体系处于平衡状态 | |
| D. | 平衡后,增大压强,平衡将向正方向移动 |
| A. | 饱和石灰水、NaOH溶液 | B. | Na2CO3溶液、AgNO3溶液 | ||
| C. | NaHCO3溶液、饱和食盐水 | D. | 氨水、石灰水 |
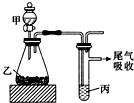 用如图装置进行实验,下列所得结论正确的是( )
用如图装置进行实验,下列所得结论正确的是( )| 甲 | 乙 | 丙 | 结论 | |
| A | 盐酸 | 石灰石 | 苯酚钠溶液 | 酸性:HCl>H2CO3>苯酚 |
| B | 盐酸 | 硫化亚铁 | 溴水 | 还原性:Cl->Br->S2- |
| C | 浓盐酸 | 高锰酸钾 | 溴化钾溶液 | 氧化性:高锰酸钾>Cl2>Br2 |
| D | 水 | 电石 | 溴水 | 稳定性:H2O>C2H2>Br2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | “接触法”制H2SO4时,催化氧化阶段的反应原理为:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0 | |
| B. | 海水提镁的主要步骤为:海水$\stackrel{CaCO_{3}(s)}{→}$Mg(OH)2(s)$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg(l)+Cl2(g) | |
| C. | 普通水泥的主要成分是硅酸钙 | |
| D. | 黏土的主要成分是三氧化二铝. |
| A. | 使用聚二氧化碳塑料会产生白色污染 | |
| B. | 聚二氧化碳塑料是通过聚合反应制得的 | |
| C. | 聚二氧化碳塑料与干冰互为同分异构体 | |
| D. | 聚二氧化碳塑干冰都属于纯净物 |
| A. | 铜 | B. | 硝酸钾 | C. | 氢氧化钠 | D. | 纯醋酸 |
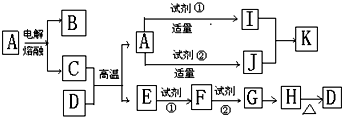
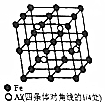 铝、铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铝、铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: .
. ,C、N、O三种元素的电负性由大到小的顺序为O>N>C.
,C、N、O三种元素的电负性由大到小的顺序为O>N>C.