题目内容
17.如图为甲同学设计的制取并检验C2H4性质的实验装置图.请回答有关问题: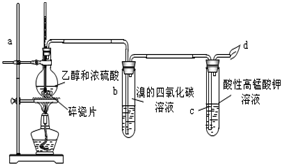
(1)写出上述制乙烯的反应的化学方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
(2)加入几片碎瓷片的目的是防止液体受热暴沸,
(3)加热时,使混合液温度迅速升高到170℃,是为了乙醇在浓硫酸作用下加热到140℃会发生分子间脱水2C2H5OH$→_{140℃}^{浓硫酸}$C2H5-O-C2H5+H2O生成乙醚,故要迅速升温到170℃,
(4)实验过程观察到的现象为:
①Br2的四氯化碳溶液由橙红色变无,
②酸性KMnO4溶液褪色.
(5)乙同学认为甲同学设计的实验如果仅从酸性KMnO4溶液褪色难以证明反应有乙烯生成,因为反应产生的乙烯中可能混有SO2气体也能使酸性KMnO4溶液褪色.写出此气体使酸性KMnO4溶液褪色的离子方程式5SO2+2MnO4-+2H2O=4H++5SO42-+2Mn2+.
分析 装置中发生装置利用浓硫酸和乙醇混合加热制备乙烯,通入溴的四氯化碳溶液会褪色,通入酸性高锰酸钾溶液中会发生氧化还原反应,溶液褪色,剩余气体燃烧除去,
(1)实验室制备乙烯所用的原料为乙醇,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃,据此写出反应的化学方程式;
(2)液体混合物加热时需防止剧烈沸腾暴沸;
(3)温度在140℃,乙醇在浓硫酸作用下发生分子间脱水,会有乙醚生成;
(4)①乙烯是不饱和烯烃,分子中含碳碳双键,和溴单质发生加成反应;
②乙烯通入高锰酸钾溶液被氧化为二氧化碳;
(5)制备乙烯反应中乙醇被碳化得到碳和浓硫酸加热反应会生成二氧化硫气体,二氧化硫具有还原性也可以使高锰酸钾溶液褪色.
解答 解:(1)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应的化学方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)为防止烧瓶内液体受热不均匀而局部突然沸腾(爆沸)冲出烧瓶,需要在烧瓶内加入几块沸石,
故答案为:防止液体受热暴沸;
(3)乙醇在浓硫酸作用下加热到140℃会发生分子间脱水2C2H5OH$→_{140℃}^{浓硫酸}$C2H5-O-C2H5+H2O生成乙醚,故要迅速升温到170℃;
故答案为:乙醇在浓硫酸作用下加热到140℃会发生分子间脱水2C2H5OH$→_{140℃}^{浓硫酸}$C2H5-O-C2H5+H2O生成乙醚,故要迅速升温到170℃;
(4)①乙烯是不饱和烯烃,分子中含碳碳双键,和溴单质发生加成反应,Br2的四氯化碳溶液为橙红色,乙烯通入后会和溴单质发生加成反应,溶液变化为无色,
故答案为:橙红; 无;
②二氧化硫具有还原性,高锰酸钾溶液具有氧化性,通入会发生氧化还原反应,二氧化硫被氧化得到硫酸,高锰酸钾溶液褪色,
故答案为:褪色;
(5)制备乙烯反应中乙醇被碳化得到碳和浓硫酸加热反应会生成二氧化硫气体,二氧化硫具有还原性也可以使高锰酸钾溶液褪色,高锰酸钾溶液褪色不能证明一定是生成的乙烯,反应的离子方程式为:5SO2+2MnO4-+2H2O=4H++5SO42-+2Mn2+,
故答案为:SO2;5SO2+2MnO4-+2H2O=4H++5SO42-+2Mn2+.
点评 本题考查了物质性质实验方案的设计,题目难度中等,试题涉及氧化还原反应的计算、氧化性还原性强弱比较、性质实验方案的设计与评价等知识,侧重学生分析能力和计算能力的考查,明确掌握浓硫酸的性质、二氧化硫的检验方法等知识为解答本题关键.

 名校课堂系列答案
名校课堂系列答案| A. | C的生成速率和B的消耗速率相等 | |
| B. | 反应混合物中A、B、C、D的浓度不再发生变化 | |
| C. | 2v正(A)=v正(B) | |
| D. | v正(A)=2v正(B) |
| A. | 4mol/LNaCl溶液与2mol/LNa2SO4溶液混合后,c(Na+)为4 mol/L | |
| B. | 240 g NaCl溶液中溶有40 g NaCl,该温度下NaCl的溶解度为20g | |
| C. | 22.4 L HCl气体溶于水制成1 L溶液,该溶液的物质的量浓度为1 mo1/L | |
| D. | 把5 g胆矾(CuSO4?5H2O)溶于45 g水中,所得溶液溶质的质量分数为10% |
| A. | X2+2Y2?2XY2 | B. | 3X2+Y2?2X3Y | C. | X2+3Y2?2XY3 | D. | 2X2+2Y2?2X2Y |
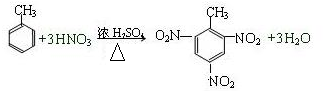
 .
. 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.