题目内容
2. 环境污染影响人类生存,治理污染是化学工作者研究的重要课题.
环境污染影响人类生存,治理污染是化学工作者研究的重要课题.(1)可用CO与H2合成甲醇(CH3OH),己知CO、CH3OH(1)、H2的燃烧热分别为:28 3.0kJ•mol-1、725.5KJ•mol-1、285.8kJ•mol-1,请写出合成CH3OH(1)的热化学方程式CO(g)+2H2(g)=CH3OH(l)△H=-129.1kJ•mol-1
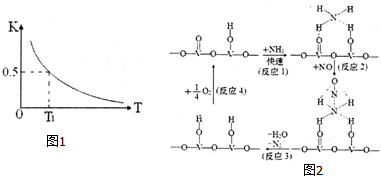
(2)反应:FeO(s)+CO(g)?Fe(s)+CO2(g)在容积固定的密闭容器中进行,其平衡常数K与温度T的关系如图1所示.
①该反应是放热(填“吸热”或“放热”)反应.
②一定条件下,下列能说明该反应达到平衡状态的是ad.
a.混合气体的密度不再变化 b.容器内压强不再变化
c.v(CO2)=v(CO) d.CO在混合气中的质量分数保持不变
③T1温度下,加入FeO和CO,反应达平衡时CO的转化率为33.3%.
(3)用V2O5作催化剂,NH3可将NO还原成N2,一种反应历程如图2所示.写出该反应化学方程式4NH3+4NO+O2$\frac{\underline{\;V_{2}O_{5}\;}}{\;}$4N2+6H2O.
(4)把含二氧化硫的工业烟气通入含Cr2O72-和Cr3+的酸性电镀废液中(Cr2O72-被还原为Cr3+),写出该反应的离子方程式3SO2+Cr2O72-+2H+=3SO42-+2Cr3++H2O.反应一段时间后开始出现Cr(OH)3沉淀,用必要的离子方程式和文字,表述产生沉淀的原因Cr3+在水溶液中存在Cr3++3H2O?Cr(OH)3+3H+,上述反应消耗了H+使上述平衡正向移动,产生Cr(OH)3沉淀.
分析 (1)根据CO、CH3OH(1)、H2的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(2)①图象甲中平衡常数曲线随温度升高增大,说明正反应为吸热反应;
②当反应达到平衡状态时,正、逆反应速率相等(同种物质),各物质的浓度、含量不再改变,以及由此衍生的一些物理量也不变,以此进行判断;
③T1温度下反应的平衡常数为2,结合平衡三段式列式计算,转化率=$\frac{转化量}{初始量}$×100%;
(3)用V2O5作催化剂,NH3可将NO还原成N2,结合反应历程图可知反应物还有氧气,生成物为N2和H2O,配平即得反应方程式;
(4)根据题给信息反应物有二氧化硫和Cr2O72-,酸性电镀废液可提供氢离子,Cr2O72-被还原为Cr3+.根据氧化还原理论二氧化硫被氧化为SO42-配平即可,上述反应消耗了氢离子,使Cr3++3H2O?Cr(OH)3+3H+水解平衡正向移动,反应一段时间后开始出现Cr(OH)3沉淀.
解答 解:(1)CO、CH3OH(1)、H2的燃烧热分别为:28 3.0kJ•mol-1、725.5KJ•mol-1、285.8kJ•mol-1,则
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$ O2(g)=CO2(g)+2 H2O(l)△H=-725.5kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1
由盖斯定律可知用①+③-$\frac{2}{3}$×②得反应CO(g)+2H2(g)=CH3OH(l),
该反应的反应热△H=-283.0kJ•mol-1+(-285.8kJ•mol-1)-$\frac{2}{3}$×(-725.5kJ•mol-1)=-129.1kJ•mol-1,即CO(g)+2H2(g)=CH3OH(l)△H=-129.1kJ•mol-1;
故答案为:CO(g)+2H2(g)=CH3OH(l)△H=-129.1kJ•mol-1;
(2)①图象甲中平衡常数曲线随温度升高而减小,说明正反应为放热反应,
故答案为:放热;
②FeO(s)+CO(g)?Fe(s)+CO2(g),反应前后是气体体积不变的放热反应,
a.在容积固定的密闭容器中进行,气体体积不变,气体质量发生变化,混合气体的密度不再变化,说明反应达到平衡状态,故a正确;
b.反应前后气体体积不变,容器内压强始终不发生变化,不能说明反应达到平衡状态,故b错误;
c.化学反应速率之比始终等于化学计量数之比,v(CO2)=v(CO),不能说明反应达平衡,故c错误;
d.CO在混合气中的质量分数保持不变,说明反应达平衡,故d正确;
故答案为:ad;
③T1温度下,向体积为V L的密闭容器中,加入FeO和CO,平衡常数为0.5,设一氧化碳起始量为x,变化量为y,FeO(s)+CO(g)?Fe(s)+CO2(g),
起始量 x 0
变化量 y y
平衡量 x-y y
平衡常数K=$\frac{y}{x-y}$=0.5,所以$\frac{y}{x}$=$\frac{1}{3}$,
二氧化碳转化率$\frac{y}{x}$=$\frac{1}{3}$=33.3%,
故答案为:33.3%;
(3)用V2O5作催化剂,NH3可将NO还原成N2,结合反应历程图可知反应物还有氧气,生成物为N2和H2O,配平即得反应方程式为4NH3+4NO+O2$\frac{\underline{\;V_{2}O_{5}\;}}{\;}$4N2+6H2O,
故答案为:4NH3+4NO+O2$\frac{\underline{\;V_{2}O_{5}\;}}{\;}$4N2+6H2O;
(4)根据题给信息反应物有二氧化硫和Cr2O72-,酸性电镀废液可提供氢离子,Cr2O72-被还原为Cr3+.根据氧化还原理论二氧化硫被氧化为SO42-配平即得离子方程式为3SO2+Cr2O72-+2H+=3SO42-+2Cr3++H2O,Cr3+在水溶液中存在Cr3++3H2O?Cr(OH)3+3H+,上述反应消耗了H+使上述平衡正向移动,产生Cr(OH)3 沉淀,
故答案为:3SO2+Cr2O72-+2H+=3SO42-+2Cr3++H2O;Cr3+在水溶液中存在Cr3++3H2O?Cr(OH)3+3H+,上述反应消耗了H+使上述平衡正向移动,产生Cr(OH)3 沉淀.
点评 本题考查了化学平衡图象分析,化学平衡状态判断,热化学方程式书写,转化率的计算,题目难度中等,涉及焓变、反应热、物质的量的计算,充分考查学生的分析、理解能力及化学计算能力,明确发生反应的原理为解答关键.

| A. | 己烷和苯 | B. | 乙烯和乙炔 | C. | 乙醇和乙醛 | D. | 甲苯和苯 |
| A. | Y位于元素周期表的第2周期第IVA族 | |
| B. | X、Y、Z、W、M的原子半径由大到小的顺序为M>Y>Z>W>X | |
| C. | X、Z、W形成的盐中只含有离子键 | |
| D. | 产生刺激性气味气体的反应离子方程式为H++HSO3-=H2O+SO2↑ |
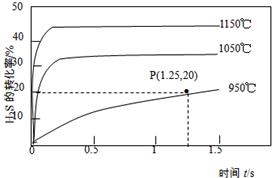 硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )| A. | 图中P点:v(正)<v(逆) | |
| B. | 正反应为放热反应 | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.008mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |
| A. | 标准状况下,11.2L的CHCl3含有的分子数为0.5NA | |
| B. | 28gSi晶体中含有Si-Si键的个数为4NA | |
| C. | 常温下,78g某浓度的乙炔的苯溶液中含碳原子数为6NA | |
| D. | 0.1 molCnH2n+2中含有的碳碳单键数为0.1nNA |
| X | Y | Z | |
| 原子半径/nm | 0.154 | 0.130 | 0.071 |
| A. | 原子最外层电子数:Z>X>Y | B. | 三种元素可能为同周期元素 | ||
| C. | 原子序数:Y>X>Z | D. | 离子半径:X>Y>Z |
| A. | (NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出 | |
| B. | 苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为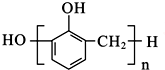 | |
| C. | 醋酸和硬脂酸互为同系物,C6H12和C9H18也一定互为同系物 | |
| D. | 迷迭香酸的结构为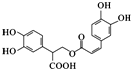 它可以发生酯化、水解但不能加成反应. 它可以发生酯化、水解但不能加成反应. |
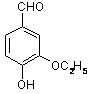 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.
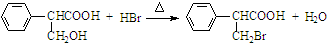 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型).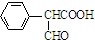 .
.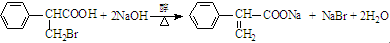 .
.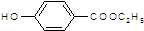 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用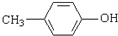 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).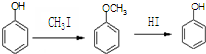
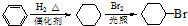
 .
.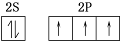 ,N2F2分子中N原子的杂化方式是sp2,1mol N2F2含有1.806×1024个σ键.
,N2F2分子中N原子的杂化方式是sp2,1mol N2F2含有1.806×1024个σ键.