题目内容
20.把9mL NO气体装入试管,倒立于水槽中,逐渐通入O2,当试管中剩余气体为3mL时,通入O2的体积可能是( )| A. | 9 mL | B. | 6.75 mL | C. | 4.5 mL | D. | 3 mL |
分析 根据NO、O2和水反应生成硝酸可知,剩余气体存在两种可能,①NO、②为O2,依据化学方程式分析氧气的体积.
解答 解:NO、O2和水反应生成硝酸,化学方程式为:4NO+3O2+2H2O=4HNO3,
若剩余3mL气体为NO,反应的NO为9ml-3ml=6ml,则通入O2的体积=6mL×$\frac{3}{4}$=4.5mL;
若剩余3mL气体为O2,9mlNO完全反应,同时消耗的氧气的体积为9mL×$\frac{3}{4}$=6.75mL,则通入O2的体积=6.75mL+3mL=9.75mL;
故选C.
点评 本题考查NO、O2和水的反应,侧重于学生的分析能力和计算能力的考查,明确发生的化学反应,结合方程式计算是解答本题的关键,难度中等.

练习册系列答案
相关题目
11.将10克Na2O2、Na2O、Na2CO3、NaOH混合物与100克质量分数3.65%的盐酸恰好反应,蒸干溶液,最终得固体质量为( )
| A. | 5.85 g | B. | 11.7 g | C. | 8 g | D. | 15.5 g |
8.下列物质中属于电解质的是( )
| A. | 盐酸 | B. | 水银 | C. | 胆矾 | D. | 乙醇 |
15.某恒温密闭容器中,可逆反应A(s)?B+C(g)-Q达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等.以下分析正确的是( )
| A. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q | |
| B. | 平衡时,单位时间内n(A)消耗﹕n(C)消耗=2﹕1 | |
| C. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 | |
| D. | 产物B的状态只能为固态或液态 |
5.同一系列烷烃,随碳原子数的增加而递减的是( )
| A. | 熔沸点 | B. | 含氢质量分数 | ||
| C. | 液态时密度 | D. | 完全燃烧时耗O2量 |
12.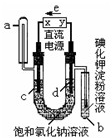 如图是电解饱和氯化钠和氯化铜混合液(滴入酚酞)的装置(电极为惰性电极),一段时间后,试管中溶液变蓝,下列判断中,正确的是( )
如图是电解饱和氯化钠和氯化铜混合液(滴入酚酞)的装置(电极为惰性电极),一段时间后,试管中溶液变蓝,下列判断中,正确的是( )
 如图是电解饱和氯化钠和氯化铜混合液(滴入酚酞)的装置(电极为惰性电极),一段时间后,试管中溶液变蓝,下列判断中,正确的是( )
如图是电解饱和氯化钠和氯化铜混合液(滴入酚酞)的装置(电极为惰性电极),一段时间后,试管中溶液变蓝,下列判断中,正确的是( )| A. | 在电解开始时,a管中有无色气体生成 | |
| B. | x极为阴性 | |
| C. | 在电解开始后,在c极附近颜色变红 | |
| D. | 通电一段时间后,混合液颜色可能变浅 |
 A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示:
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示: