题目内容
(1)铅蓄电池放电时发生下列反应负极:Pb+SO42--2e-=PbSO4正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O,用该电池电解CuSO4溶液,当有纯铜1.6g析出时,铅蓄电池内消耗硫酸物质的量为
(2)锌、溴蓄电池的充、放电的电池总反应为Zn+Br2 Zn2++2Br-.下列各反应①Zn-2e-═Zn2+ ②Br2+2e-═2Br- ③2Br--2e-═Br2 ④Zn2++2e-═Zn,其中充电时的阳极反应式为 ,放电时负极的反应式是
(3)目前人们正研究开发一种高能电池一-钠硫电池,它是以熔融的钠、硫为两极,以Na+ 导电的β,--Al2O3陶瓷作固体电解质,反应如下:2Na+xS Na2Sx,其正极反应式为
,当外电路转移4mol电子时消耗硫单质的质量为 .
(2)锌、溴蓄电池的充、放电的电池总反应为Zn+Br2 Zn2++2Br-.下列各反应①Zn-2e-═Zn2+ ②Br2+2e-═2Br- ③2Br--2e-═Br2 ④Zn2++2e-═Zn,其中充电时的阳极反应式为
(3)目前人们正研究开发一种高能电池一-钠硫电池,它是以熔融的钠、硫为两极,以Na+ 导电的β,--Al2O3陶瓷作固体电解质,反应如下:2Na+xS Na2Sx,其正极反应式为
考点:常见化学电源的种类及其工作原理,化学电源新型电池
专题:电化学专题
分析:(1)n(Cu)=
=0.025mol,铅蓄电池放电时总反应为Pb+PbO2+2H2SO4=2PbSO4↓+2H2O,结合反应的方程式计算;
(2)充电时,该装置是电解池,阳极上失电子发生氧化反应;放电时,该装置是原电池,负极上失电子发生氧化反应;
(3)原电池放电时,负极上失电子发生氧化反应,正极上得电子发生还原反应,根据电极反应确定电子转移和消耗的物质的量之间的关系.
| 1.6g |
| 64g/mol |
(2)充电时,该装置是电解池,阳极上失电子发生氧化反应;放电时,该装置是原电池,负极上失电子发生氧化反应;
(3)原电池放电时,负极上失电子发生氧化反应,正极上得电子发生还原反应,根据电极反应确定电子转移和消耗的物质的量之间的关系.
解答:
(1)n(Cu)=
=0.025mol,转移电子0.05mol,铅蓄电池放电时总反应为Pb+PbO2+2H2SO4=2PbSO4↓+2H2O,可知转移电子0.05mol,消耗0.05molH2SO4,
故答案为:0.05 mol;
(2)充电时,该装置是电解池,阳极上溴离子失电子生成溴单质而发生氧化反应,即2Br--2e-═Br2;放电时,该装置是原电池,负极上锌失电子生成锌离子而发生氧化反应,即Zn-2e-═Zn2+,故答案为:2Br--2e-═Br2;Zn-2e-═Zn2+;
(3)电池总反应为 2Na+xS
Na2Sx,原电池正极发生得电子的还原反应,在反应2Na+xS=Na2Sx中,硫单质得电子,故正极反应为:xS+2e-=Sx2-;外电路转移4mol电子时,消耗硫单质的质量为64xg,故答案为:xS+2e-=Sx2-;64x.
| 1.6g |
| 64g/mol |
故答案为:0.05 mol;
(2)充电时,该装置是电解池,阳极上溴离子失电子生成溴单质而发生氧化反应,即2Br--2e-═Br2;放电时,该装置是原电池,负极上锌失电子生成锌离子而发生氧化反应,即Zn-2e-═Zn2+,故答案为:2Br--2e-═Br2;Zn-2e-═Zn2+;
(3)电池总反应为 2Na+xS
| 放电 |
| 充电 |
点评:本题考查原电池和电解池知识,为电化学高频考点,侧重于学生的分析能力和计算能力的考查,注意把握原电池的总反应,为解答该题的关键,难度不大.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
已知次氯酸是比碳酸还弱的酸,反应Cl2+H2O?HCl+HClO达平衡后,要使HClO浓度增大,可加入( )
| A、足量6mol/L NaOH溶液 |
| B、少量6mol/L H2SO4溶液 |
| C、少量NaHCO3固体 |
| D、足量Na2SO3溶液 |
为了预防缺铁性贫血,人体必须保证足够的铁的摄入,这里的“铁”是指( )
| A、铁单质 | B、铁元素 |
| C、氢氧化铁 | D、氧化铁 |
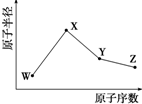 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.