题目内容
9. (1)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是b
(1)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是ba.NH3 b.HI c.SO2 d.CO2
(2)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4
(3)工业生产甲醇的常用方法是:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.
已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1527.6KJ/mol.
(4)某实验小组设计了如图所示的甲醇燃料电池装置.
①该电池工作时,负极是b极(填“a”或“b”);
②工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为CH3OH+8OH--6e-=CO32-+6H2O.
(5)电解法促进橄榄石(主要成分是Mg2SiO4)固定CO2的部分工艺流程如下:
已知:Mg2SiO4(s)+4HCl(aq)═2MgCl2(aq)+SiO2 (s)+2H2O(l)△H=-49.04kJ•mol-1

①某橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为9MgO•FeO•5SiO2.
②在上图虚框内补充一步工业生产流程
 .
.③经分析,所得碱式碳酸镁产品中含有少量NaCl和Fe2O3.为提纯,可采取的措施依次为:对溶解后所得溶液进行除铁处理、对产品进行洗涤处理.判断产品洗净的操作是取少量最后一次的洗涤液,加硝酸酸化的硝酸银溶液,如无沉淀产生,则已洗净.
分析 (1)浓硫酸具有强氧化性、酸性,P2O5是非氧化性干燥剂,然后结合各选项中气体的性质进行判断;
(2)根据题干信息判断该无氧酸盐为氯化钾,再根据化合价变化判断另一种无氧酸盐名称,最后根据化合价升降相等配平即可;
(3)a、CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.
b、2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol;
c、2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
依据盖斯定律计算c+b×2-a×2;
(4)燃料电池的工作原理:电池的负极一定是燃料失电子,发生氧化反应,在正极上一定氧气得电子,发生还原反应;
(5)①硅酸盐是构成地壳岩石的主要成分,化学上常用二氧化硅和氧化物的形式表示其组成,例如:镁橄榄石(Mg2SiO4)常以2MgO•SiO2表示,可看出改写中要保证原子总数,化合价不变,按化合价分别写出氧化物的化学式,如有多个原子,在前面加上系数,使之成为倍数,据此进行分析解答;
②工业上用氯电解饱和食盐水会获得烧碱;
③氯离子的检验用硝酸酸化的硝酸银.
解答 解:(1)浓硫酸具有强氧化性、酸性,不能干燥具有还原性、碱性的气体,
a.NH3为碱性气体,不能用浓硫酸和五氧化二磷干燥,可用碱石灰干燥,故a错误;
b.HI为还原性气体,不能利用浓硫酸干燥,可以利用P2O5干燥,故b正确;
c.二氧化硫为酸性气体,可以用浓硫酸、五氧化二磷或无水氯化钙干燥,故c错误;
d.二氧化碳为酸性气体,可以用浓硫酸、五氧化二磷或无水氯化钙干燥,故d错误;
故选b;
(2)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,则该无氧酸为KCl,KCl中氯元素化合价为-1,说明氯酸钾中氯元素化合价降低,则另一种含氧酸盐中氯元素化合价会升高,由于氯酸钾中氯元素化合价为+5,则氯元素化合价升高只能被氧化成高氯酸钾,根据氧化还原反应中化合价升降相等配平该反应为:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4,
故答案为:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4;
(3)a、CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.
b、2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol;
c、2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
依据盖斯定律计算c+b×2-a×2得到热化学方程式为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1527.6KJ/mol;
故答案为:-1527.6KJ/mol;
(4)①燃料电池的工作原理:电池的负极一定是燃料失电子,发生氧化反应,在正极上一定氧气得电子,发生还原反应,所以a为正极,b是负极;
故答案为:b;
②电池负极是燃料甲醇发生失电子的氧化反应,在碱性环境下,反应的电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O;
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(5)①根据硅酸盐写成氧化物的规律,Mg9FeSi5O20用氧化物的形式可表示为9MgO•FeO•5SiO2,故答案为:9MgO•FeO•5SiO2;
②根据流程图,固碳时主要反应的方程式为NaOH(aq)+CO2 (g)=NaHCO3 (aq),工业上用氯电解饱和食盐水会获得烧碱,缺少烧碱的制取流程,故答案为: ;
;
③判断产品洗净只需要检验洗涤液中不含有氯离子即可,氯离子的检验用硝酸酸化的硝酸银,操作是:取少量最后一次的洗涤液,加硝酸酸化的硝酸银溶液,如无沉淀产生,则已洗净,
故答案为:取少量最后一次的洗涤液,加硝酸酸化的硝酸银溶液,如无沉淀产生,则已洗净.
点评 本题是一道关于盖斯定律的应用以及计算、电化学以及工业流程等知识的综合考查题,考查学生分析和解决问题的能力,难度大.

| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| C. | 1L0.1mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| D. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n净产生的中子(${\;}_{0}^{1}$n)数为10NA |
| A. | Na3N与水的反应是氧化还原反应 | |
| B. | Na3N 是共价化合物 | |
| C. | Na3N中4个离子均满足最外层8电子稳定结构 | |
| D. | Na3N中钠离子半径大于氮离子半径 |
| A. | 稀醋酸中加入少量醋酸钠固体能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液呈中性 | |
| C. | 25℃时,0.1mol•L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| D. | FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 |

| A. | 已知图①是体系Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq) 中的c[Fe(SCN)2+]温度T的平衡图象.A点与B点相比,A点的c(Fe3+) 大 | |
| B. | 图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 | |
| C. | 图③表示电源X极为正极,U形管中为AgNO3溶液,则b管中电极反应式是:4OH--4e-=O2↑+2H2O | |
| D. | 图④表示分离CCl4萃取碘水后已分层的有机层和水层 |
| A. | 1.35g | B. | 0.27g | C. | 0.54g | D. | 2.7g |
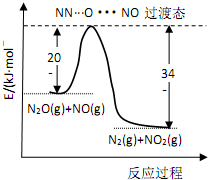 由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )
由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )| A. | 由图分析 N2O(g) 的能量一定高于 NO2(g)+N2(g) | |
| B. | 反应过程中没有发生化学键的断裂和化学键的生成 | |
| C. | 若生成 1mol N2(g),其△H=-139kJ•mol-1 | |
| D. | 由图可知 N2+NO2=N2O+NO△H=+139kJ•mol-1, 若使用催化剂还可以减小反应的热效应 |

