题目内容
17.将广泛应用于航空工业的某合金(两种金属组成)投入过量浓硝酸中,合金与硝酸剧烈反应,放出红棕色气体X和蓝绿色溶液Y.若将少量Y滴入NaCl溶液中,只产生白色沉淀.(1)氯元素在周期表中的位置:第三周期ⅦA族.
(2)组成合金的金属是D(填选项字母).
A.Cu,Mg B.Cu,Al C.Cu,Fe D.Cu,Ag
(3)X是大气污染物之一,利用氨水可以将SO2和X同时吸收处理,原理如图所示:
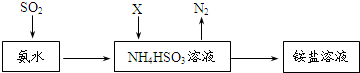
NO2被吸收的离子方程式是2NO2+4HSO3-=N2+4SO42-+4H+.
分析 合金与硝酸剧烈反应,放出红棕色气体X就为NO2,和蓝绿色溶液Y,溶液中应含有铜离子,若将少量Y滴入NaCl溶液中,只产生白色沉淀,则Y中应含有有银离子,氯元素是17号元素,有三个电子层,最外层有7个电子,二氧化硫与二氧化氮发生氧化还原反应,据此答题.
解答 解:合金与硝酸剧烈反应,放出红棕色气体X就为NO2,和蓝绿色溶液Y,溶液中应含有铜离子,若将少量Y滴入NaCl溶液中,只产生白色沉淀,则Y中应含有有银离子,氯元素是17号元素,有三个电子层,最外层有7个电子,亚硫酸氢根与二氧化氮发生氧化还原反应,
(1)氯元素在周期表中的位置是第三周期ⅦA族,故答案为:第三周期ⅦA族;
(2)根据上面的分析可知,组成合金的金属是Cu、Ag,故选D;
(3)氨水可以将SO2和NO2同时吸收处理,二氧化硫与氨水反应生成亚硫酸氢根离子,NO2被吸收的离子方程式是2NO2+4HSO3-=N2+4SO42-+4H+,
故答案为:2NO2+4HSO3-=N2+4SO42-+4H+.
点评 本题主要考查了元素周期表、常见金属的性质、氧化还原反应离子方程式,难度不大,注意根据物质的性质进行物质推断,注重对基础知识的考查.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
7.下列各物质中,按熔点由低到高排列正确的是( )
| A. | O2、I2、Hg | B. | CO2、KCl、SiO2 | ||
| C. | HF、HCl、HBr | D. | CH4、C2H5OH、C4H10 |
8.下列解释事实的方程式正确的是( )
| A. | 利用铝热反应焊接钢轨:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3 | |
| B. | 用氯水除去FeCl3溶液中的Fe2+:Cl2+Fe2+═2Cl-+Fe3+ | |
| C. | 用已知浓度的NaOH溶液测定未知浓度的醋酸溶液的浓度:H++OH-═H2O | |
| D. | 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2Na++2OH-═Na2SiO3+H2O |
5.卤代烃在生产生活中具有广泛的应用,下列说法正确的是( )
| A. | 多氯代甲烷中分子结构为正四面体的是二氯甲烷和四氯化碳 | |
| B. | 多氯代烷常为有机溶剂,工业上分离这些多氯代物的方法是萃取 | |
| C. | 三氟氯溴乙烯(CF3CHClBr)是一种麻醉剂,有4种同分异构体(不考虑立体异构) | |
| D. | 聚氯乙烯是生活中常用的塑料,工业上以乙烯为原料经过加成、消去和聚合反应可生成聚氯乙烯 |
2.下列有关说法中正确的是( )
| A. | 100g98%的浓H2SO4中所含的氧原子数为4NA(NA为阿伏伽德罗常数,下同) | |
| B. | 3.1g白磷晶体中含有的P-P键数是0.6NA | |
| C. | 向Ca(HCO3)2溶液中加入Ca(OH)2溶液至过量:Ca2++2HCO3-+2OH-═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O | |
| D. | 冰水中常会形成(H2O)x(x≥1)分子,原因是存在氢键 |
9.下列关于25℃的NaHCO3溶液的相关事实,能够证明H2CO3为弱酸的是( )
| A. | 溶液中存在CO32- | B. | 溶液中c(Na+)>c(CO32-) | ||
| C. | 与等物质的量的NaOH恰好中和 | D. | 溶液中c(H+)•c(OH-)=10-14 |
6.表中的W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
| X | Y | ||
| W | Z |
| A. | 最高价氧化物对应水化物的酸性:Z>X>W | |
| B. | 最低价氢化物的沸点:Z>Y>X | |
| C. | 原子半径:W>X>Y>Z | |
| D. | 由X、Y和氢三种元素只能形成含有共价键的化合物 |
5.下列反应中,可以使碳链增长的是( )
| A. | 1溴丙烷与NaOH的醇溶液共热 | B. | 乙醛与H2加成 | ||
| C. | 乙醇与浓H2SO4共热到140℃ | D. | 1-溴丙烷与NaOH的水溶液共热 |
 .
.