题目内容
17.下列各组离子一定能大量共存的是( )| A. | 在含有大量 Al3+的无色溶液中:Cu2+、Na+、Cl-、SO 42- | |
| B. | 在含有大量 H+的 溶液中:Na+、K+、CO 32-、NO3- | |
| C. | 在强酸的溶液中:NH4+、Na+、SO42-、Cl- | |
| D. | 在滴加石蕊显蓝色的溶液中:K+、Cu2+、Cl-、NO2- |
分析 A.有颜色的离子不能大量共存;
B.与H+反应的离子不能大量共存;
C.离子之间不发生任何反应;
D.滴加石蕊显蓝色的溶液呈碱性.
解答 解:A.Cu2+有颜色,不能大量共存,故A错误;
B.CO32-与H+反应,不能大量共存,故B错误;
C.在强酸的溶液中离子之间不发生任何反应,可大量共存,故C正确;
D.滴加石蕊显蓝色的溶液呈碱性,Cu2+不能大量共存,故D错误.
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解的离子共存考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.某学生对Na2SO3与AgNO3在不同 pH 下的反应进行探究.
(1)测得Na2SO3溶液 pH=10、AgNO3 溶液 pH=5.
(2)调节 pH,实验记录如表:
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3 溶液.
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应.
该学生对 a 中的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3
②白色沉淀为Ag2SO4,推测的依据是SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成Ag2SO4白色沉淀.
(3)取 b、c 中白色沉淀,置于Na2SO3溶液中,沉淀溶解.该同学设计实验确认了白色沉淀不是Ag2SO4.实验方法是:另取Ag2SO4固体置于Na2SO3溶液中,未溶解.
(4)将 c 中 X 滤出、洗净,为确认其组成,实验如下:
Ⅰ.向 X 中滴加稀盐酸,无明显变化.
Ⅱ.向 X 中加入过量浓硝酸,产生红棕色气体.
Ⅲ.用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色
沉淀.
①实验Ⅰ的目的是检验棕黑色物质X是否为Ag2O.
②根据上述现象,分析 X 的成分是Ag.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)═AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析 X 产生的原因是:随着酸性的增强,体系的还原性强.
(1)测得Na2SO3溶液 pH=10、AgNO3 溶液 pH=5.
(2)调节 pH,实验记录如表:
| 实验 | pH | 现象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3 溶液.
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应.
该学生对 a 中的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3
②白色沉淀为Ag2SO4,推测的依据是SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成Ag2SO4白色沉淀.
(3)取 b、c 中白色沉淀,置于Na2SO3溶液中,沉淀溶解.该同学设计实验确认了白色沉淀不是Ag2SO4.实验方法是:另取Ag2SO4固体置于Na2SO3溶液中,未溶解.
(4)将 c 中 X 滤出、洗净,为确认其组成,实验如下:
Ⅰ.向 X 中滴加稀盐酸,无明显变化.
Ⅱ.向 X 中加入过量浓硝酸,产生红棕色气体.
Ⅲ.用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色
沉淀.
①实验Ⅰ的目的是检验棕黑色物质X是否为Ag2O.
②根据上述现象,分析 X 的成分是Ag.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)═AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析 X 产生的原因是:随着酸性的增强,体系的还原性强.
8.某有机物的结构简式如图所示,其正确的命名是( )
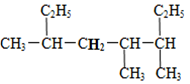
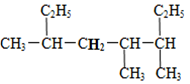
| A. | 4,5-二甲基-2-乙基庚烷 | B. | 3,4-二甲基-6-乙基庚烷 | ||
| C. | 4-甲基-2,5-二乙基己烷 | D. | 3,4,6-三甲基辛烷 |
12.下列分离或提纯物质的方法正确的是( )
| A. | 用过滤的方法分离氢氧化铁胶体和氯化铁溶液 | |
| B. | 用汽油萃取溴水中的溴 | |
| C. | 用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钾 | |
| D. | 用分液可分离乙酸乙酯和乙醇混合物 |
2.下列各项中.两种物质在溶液中的反应可用同一离子方程式表示的是( )
| A. | 磷酸与烧碱、硝酸与澄淸石灰水 | |
| B. | 氯化钡与硫酸钠、硫酸与硝酸钡 | |
| C. | 碳酸铵与氢氧化钠、碳酸铵与石灰乳 | |
| D. | 纯碱与硫酸、碳酸氢钾与盐酸 |
9.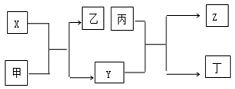 由短周期主族元素X、Y、Z组成的单质(化学式也分别为X、Y、Z),X为金属,其核外电子数为Y原子序数的2倍,Y的最低负化合价与Z的最高正化合价的数值相等,甲、乙、丙、丁四种均为氧化物,甲和丁为无色的气体,固体甲可用于人工降雨,乙和丙熔点均很高,且它们在一定条件下能发生如下反应,下列说法中正确的是( )
由短周期主族元素X、Y、Z组成的单质(化学式也分别为X、Y、Z),X为金属,其核外电子数为Y原子序数的2倍,Y的最低负化合价与Z的最高正化合价的数值相等,甲、乙、丙、丁四种均为氧化物,甲和丁为无色的气体,固体甲可用于人工降雨,乙和丙熔点均很高,且它们在一定条件下能发生如下反应,下列说法中正确的是( )
 由短周期主族元素X、Y、Z组成的单质(化学式也分别为X、Y、Z),X为金属,其核外电子数为Y原子序数的2倍,Y的最低负化合价与Z的最高正化合价的数值相等,甲、乙、丙、丁四种均为氧化物,甲和丁为无色的气体,固体甲可用于人工降雨,乙和丙熔点均很高,且它们在一定条件下能发生如下反应,下列说法中正确的是( )
由短周期主族元素X、Y、Z组成的单质(化学式也分别为X、Y、Z),X为金属,其核外电子数为Y原子序数的2倍,Y的最低负化合价与Z的最高正化合价的数值相等,甲、乙、丙、丁四种均为氧化物,甲和丁为无色的气体,固体甲可用于人工降雨,乙和丙熔点均很高,且它们在一定条件下能发生如下反应,下列说法中正确的是( )| A. | X为第三周期II族元素,Y和Z位于同一主族 | |
| B. | 甲、乙、丙均能与水发生化合反应 | |
| C. | 工业上常用电解乙制备X | |
| D. | X可用于制焰火烟花,Z可用作太阳能电池的材料 |
20.对于相同体积的K2CO3溶液(浓度为c1)和溶液(NH4)2CO3(浓度为c2),若其中CO32-的物质的量浓度相同,则c1和c2的关系是( )
| A. | c1=2c2 | B. | c1>c2 | C. | c1=c2 | D. | c1<c2 |
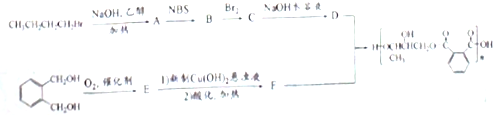

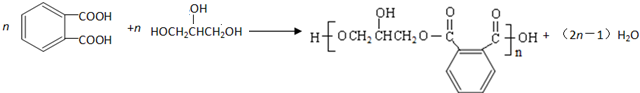
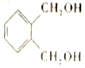 的符合下列条件的同分异构体有6 种(不考虑立体异构)
的符合下列条件的同分异构体有6 种(不考虑立体异构)