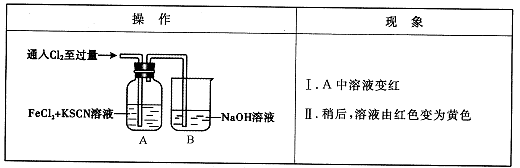
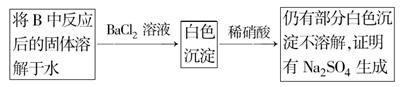
题目内容
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中
铁元素的含量。实验步骤如下:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加________,该过程的现象为________。
(2)步骤②加入过量H2O2的目的是:______________________________________。
(3)步骤③中反应的离子方程式是:_______________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、________、灼烧、________、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为________g。
(1)氯水(或双氧水、稀硝酸等合理氧化剂) 溶液由浅绿色变为红色
(2)将Fe2+全部氧化为Fe3+
(3)Fe3++3OH-=Fe(OH)3↓
[或Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+]
(4)洗涤 冷却 (5)0.07 a
解析

练习册系列答案
相关题目
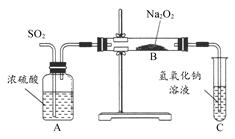
实验目的:探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后退色的原因。
[分析与猜想]
(1)根据过氧化钠与水反应的原理:2Na2O2 + 2H2O =" 4NaOH" + O2↑,往过氧化钠固体完全溶解反应后的溶液中滴加酚酞本应只会变红而不会退色,而实验中发现酚酞变红后又退色。由此提出如下的猜想:
A.氧气有漂白性
B.氢氧化钠有漂白性
C.
[实验与判断] 请完成下列表格:
| 实验编号 | 1 | 2 | 3 |
| 实验装置 | 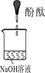 | 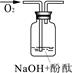 | 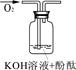 |
| 验证猜想 | | C | |
| 实验现象 | 溶液变红后不退色 | ||
| 实验说明 | 1、2的实验中NaOH溶液是用 (填“氢氧化钠固体”、“氧化钠固体”、“过氧化钠固体”)溶于水配制的。 | ||
(2)根据以上实验分析发现:过氧化钠与水反应过程中,钠元素形成了稳定的化合物,溶液中还生成了一种不很稳定、具有漂白性的物质X,X的化学式是 。
(3)可用右图装置对溶液中不很稳定的物质进行探究,在①处装入的物质是 (填选项,下同),②处装入的物质是 。
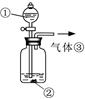
A.酚酞试剂 B.过氧化钠与水反应后的溶液
C.二氧化锰 D.氢氧化钠固体配制的溶液
(4)气体③是 ,过氧化钠与水反应的化学方程式没有写出X来,原因是 。