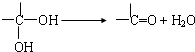
题目内容
14.某有机物2.3克在空气中完全燃烧,生成二氧化碳2.24升(标准状况)和2.7克水.已知这种有机物的蒸气密度是相同状况下氢气密度的23倍.试通过计算写出这种有机物的分子式及可能的结构简式.分析 某有机物的蒸气密度是相同状况下氢气的23倍,则该有机物的相对分子质量=23×2=46,计算有机物、二氧化碳、水的物质的量,根据原子守恒计算分子中C、H原子数目,再结合相对分子质量确定氧原子数目,进而确定分子式,书写可能的结构简式.
解答 解:某有机物的蒸气密度是相同状况下氢气的23倍,则该有机物的相对分子质量=23×2=46,
2.3g有机物的物质的量=$\frac{2.3g}{46g/mol}$=0.05mol、CO2的物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol、H2O的物质的量=$\frac{2.7g}{18g/mol}$=0.15mol,
根据原子守恒可知,有机物分子中C原子数目=$\frac{0.1mol}{0.05mol}$=2、H原子数目=$\frac{0.15mol×2}{0.05mol}$=6,故O原子数目=$\frac{46-12×2-6}{16}$=2,故该有机物分子式为C2H6O,可能的结构简式为CH3CH2OH或CH3OCH3,
答:有机物分子式为C2H6O,可能的结构简式为CH3CH2OH或CH3OCH3.
点评 本题考查有机物分子式确定、同分异构体书写,掌握燃烧法利用原子守恒确定有机物分子式.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
5.将下列物质分别加入水中,振荡后静置,能分层且浮于水面上的是( )
| A. | 溴苯 | B. | 汽油 | C. | 硝基苯 | D. | 乙酸 |
2.下列烃在光照下与氯气反应,只生成一种一氯代物的有( )
| A. | 2-甲基丙烷 | B. | 环戊烷 | C. | 2,2二甲基丁烷 | D. | 2,2-甲基丙烷 |
9.NaClO是84消毒液的主要成分下列错误的是( )
| A. | 工业制备NaClO可用电解饱和食盐水的方法离子方程式为:Cl-+H2O $\frac{\underline{\;电解\;}}{\;}$ ClO-+H2↑ | |
| B. | 向NaClO溶液中通入少量SO2气体离子方程式为:SO2+3ClO-+2H2O═2HClO+SO42-+Cl- | |
| C. | 在NaClO溶液中可以大量共存的离子有:K+,SO42-,Fe3+,NO3- | |
| D. | 84消毒液不能和洁厕剂混合使用,也不能用pH试纸测其pH值. |
19.2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)?PCl5(g)达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
| A. | 0.40 mol | B. | 0.20 mol | ||
| C. | 小于0.20 mol | D. | 大于0.20 mol,小于0.40 mol |
6.将充满20mLNO的试管倒置于盛有蒸镏水的烧杯中,然后向试管里通入纯氧气,当试管内液面稳定在试管容积的$\frac{4}{5}$时,则通入O2为可能( )
| A. | 12mL | B. | 15 mL | C. | 19mL | D. | 31mL |
3.下列叙述正确的是( )
| A. | 同温同压下,相同体积的气体,其气体分子物质的量也相等 | |
| B. | 任何条件下,等物质的量的甲烷和一氧化碳所含的分子数可能不相等 | |
| C. | 不同的气体,若体积不同,则它们所含的分子数也不同 | |
| D. | 同温同压下,若体积不相等,则一氧化碳气体和氮气质量可能相等 |
4.金属钛对人体体液无毒且有惰性,能与肌肉和骨骼生成在一起,故有“生命金属”之称.下列有关4822Ti和5022Ti的说法正确的是( )
| A. | 质量数相同,互为同位素 | |
| B. | 质子数相同,互为同位素 | |
| C. | 中子数相同,属同一种元素的不同核素 | |
| D. | 核外电子数相同,中子数不同,不能互称为同位素 |
 .
. .
.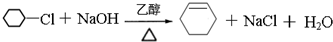 .
.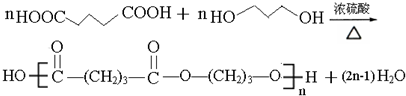 .
.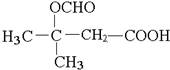 (写出其中一种结构简式).
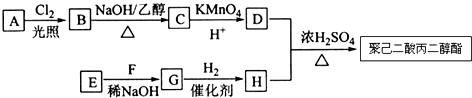
(写出其中一种结构简式).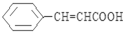 )的合成路线示意图.
)的合成路线示意图.