题目内容
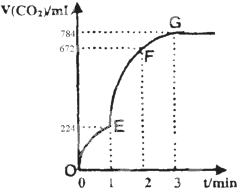 用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积).
用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积).(1)下列分析不正确的是
A.OE段表示的平均速率最快
B.EF段,用盐酸表示该反应的平均反应速率为0.4mol/(L?min)
C.EF段表示的平均速率最快,主要原因是反应放热
D.G点表示收集的CO2的量最多
(2)为了降低上述化学反应的反应速率,欲向溶液中加入下列物质,你认为可行的是
A.蒸馏水 B.NaCl固体 C.CH3COONa固体 D.浓盐酸
(3)除了上述方法外,你认为还可以采取哪些措施来降低化学反应速率?
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:(1)A.斜率表示反应速率,斜率越大反应速率越大;
B.根据EF段生成二氧化碳的体积计算氯化氢的物质的量的变化量,进而计算氯化氢浓度变化,根据v=
计算用盐酸表示该反应的平均反应速率
C.EF段浓度逐渐减小,但温度升高;
D.G点表示收集的二氧化碳为从开始到G点生成的二氧化碳,
(2)(3)降低上述化学反应的反应速率,可降低氢离子浓度或降低温度.
B.根据EF段生成二氧化碳的体积计算氯化氢的物质的量的变化量,进而计算氯化氢浓度变化,根据v=
| △c |
| △t |
C.EF段浓度逐渐减小,但温度升高;
D.G点表示收集的二氧化碳为从开始到G点生成的二氧化碳,
(2)(3)降低上述化学反应的反应速率,可降低氢离子浓度或降低温度.
解答:
解:(1)A.斜率表示反应速率,斜率越大反应速率越大,由图可知,EF段斜率最大,所以EF段反应速率最大,故A错误;
B.由图可知EF段生成的二氧化碳的体积为672ml-224ml=448ml,所以二氧化碳的物质的量为
=0.02mol,根据CaCO3+2HCl═CaCl2+CO2↑+H2O,可知参加反应的氯化氢的物质的量为0.04mol,所以盐酸的浓度变化量为
=0.4mol/L,所以EF段用盐酸表示该反应的平均反应速率为
=0.4mol/(L?min),故B正确;
C.EF段浓度逐渐减小,但温度升高,导致反应速率增大,故C正确;
D.G点表示收集的二氧化碳为从开始到G点生成的二氧化碳,总共784ml,故D正确.
故答案为:A;
(2)A.加入蒸馏水,溶液浓度降低,反应速率减小,故A正确;
B.NaCl固体,溶液浓度不变,反应速率不变,故B错误;
C.加入CH3COONa固体,氢离子浓度减小,反应速率减小,故C正确;
D.加入浓盐酸,氢离子浓度增大,反应速率增大,故D错误.
故答案为:AC;
(3)除降低反应浓度之外,降低反应温度等,也可减小反应速率,故答案为:降低反应的温度.
B.由图可知EF段生成的二氧化碳的体积为672ml-224ml=448ml,所以二氧化碳的物质的量为
| 0.448L |
| 22.4L/mol |
| 0.04mol |
| 0.1L |
| 0.4mol/L |
| 1min |
C.EF段浓度逐渐减小,但温度升高,导致反应速率增大,故C正确;
D.G点表示收集的二氧化碳为从开始到G点生成的二氧化碳,总共784ml,故D正确.
故答案为:A;
(2)A.加入蒸馏水,溶液浓度降低,反应速率减小,故A正确;
B.NaCl固体,溶液浓度不变,反应速率不变,故B错误;
C.加入CH3COONa固体,氢离子浓度减小,反应速率减小,故C正确;
D.加入浓盐酸,氢离子浓度增大,反应速率增大,故D错误.
故答案为:AC;
(3)除降低反应浓度之外,降低反应温度等,也可减小反应速率,故答案为:降低反应的温度.
点评:本题综合考查反应速率计算、比较等,为高频考点,题目旨在考查学生对图表的理解,题目难度不大,注意浓度(物质的量)与时间图象,斜率表示反应速率.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案
相关题目
在t℃时,将agNH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρg?cm-1,质量分数为ω,其中含NH4+的物质的量为b moL.下列叙述中正确的是( )
A、溶质的质量分数为ω=
| ||
B、溶质的物质的量浓度c=
| ||
C、溶液中c (OH-)=
| ||
| D、上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω |
自来水常用氯气进行消毒.某实验室用自来水配制下列物质的溶液,不会产生明显药品变质问题的是( )
| A、FeCl2 |
| B、Na2SO3 |
| C、NaOH |
| D、AlCl3 |
在温度不变的条件下,密闭容器中发生如下反应:2SO2+O2?2SO3,下列叙述能够说明反应已经达到平衡状态的是( )
| A、反应容器中压强不随时间变化 |
| B、容器中SO2、O2、SO3的物质的量之比为2:1:2 |
| C、SO2与SO3的浓度相等 |
| D、容器中SO2、O2、SO3共存 |
下列说法正确的是( )
| A、放热反应发生时不必加热,吸热反应在加热后才能发生 |
| B、反应热指的是反应过程中放出的热量 |
| C、反应热的大小与反应的途径有关,无论是一步完成还是分几步完成,其反应热基本相同 |
| D、依据盖斯定律,热化学方程式具有加合性,也可以进行加、减、乘、除四则运算 |
肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液.电池总反应为:N2H4+O2=N2↑+2H2O.下列关于该燃料电池工作时的说法正确的是( )
| A、负极的电极反应式是:N2H4+4OH--4e-=4H2O+N2↑ |
| B、正极的电极反应式是:O2+4H++4e-=2H2O |
| C、溶液中阴离子向正极移动 |
| D、溶液中C﹙OH-﹚保持不变 |
