题目内容
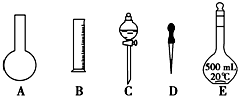
14.实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:(1)如图所示的仪器中配制溶液肯定不需要的是A、C;(填序号),配制上述溶液还需用到的玻璃仪器是烧杯和玻璃棒(填仪器名称).
(2)配制NaOH时,在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度小于0.1mol/L(填“大于”、“等于”或“小于”).
(3)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为13.6mL(计算结果保留一位小数).在实验中其他操作均正确,若用量筒量取浓硫酸时仰视刻度线,则所得配得溶液浓度大于0.5mol/L(填“大于”、“等于”或“小于”).
分析 (1)根据配制一定物质的量浓度溶液用到仪器进行解答;
(2)根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断;
(3)先依据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释前后所含溶质的物质的量不变计算需要浓硫酸的体积;用量筒量取浓硫酸时仰视刻度线导致浓硫酸的体积偏大.
解答 解:(1)配制一定物质的量浓度溶液用的仪器有:托盘天平、药匙、烧杯、筒量、玻璃棒、容量瓶、胶头滴管,不需要的仪器有烧瓶和分液漏斗,还需用到的玻璃仪器是烧杯、玻璃棒;
故答案为:A、C;烧杯和玻璃棒;
(2)若定容时仰视刻度线,则导致溶液的体积偏大,所以配制溶液的浓度偏低,故所得溶液浓度小于0.1mol/L;
故答案为:小于;
(3)质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$=18.4(mol/L),设需要浓硫酸的体积为V,依据溶液稀释前后所含溶质的物质的量不变设需要浓硫酸的体积为V,则:V×18.4mol/L=500mL×0.5mol/L,解得V=13.6ml;
用量筒量取浓硫酸时仰视刻度线导致浓硫酸的体积偏大,量取硫酸的物质的量偏大,依据c=$\frac{n}{V}$,可知溶液的浓度偏高;
故答案为:13.6;大于.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和过程是解题关键,注意误差分析的方法和技巧,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
4.在25℃、1.01×105Pa下,将22g CO2通入到750mL 1.0mol•L-1的NaOH溶液中充分反应,放出x kJ热量.在该条件下1molCO2通入到2L 1.0mol•L-1的NaOH溶液中充分反应,放出ykJ热量,则CO2与NaOH反应生成NaHCO3的热化学反应方程式为( )
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(8x-2y) kJ•mol-1 |
5.下列物质中不能与溴水发生反应的是( )
①苯 ②苯酚 ③亚硫酸 ④NaOH溶液 ⑤AgNO3溶液 ⑥裂解汽油 ⑦己烷 ⑧镁粉.
①苯 ②苯酚 ③亚硫酸 ④NaOH溶液 ⑤AgNO3溶液 ⑥裂解汽油 ⑦己烷 ⑧镁粉.
| A. | ①⑦ | B. | ①③⑥ | C. | ①⑥⑦⑧ | D. | ①②⑤⑦ |
2.如表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
(1)在这些元素中,化学性质最不活泼的元素是Ne,元素原子半径最大的是K,
(2)在上述元素的最高价氧化物对应水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是KOH,既能与强酸反应,又能与强碱反应的化合物的化学式是Al(OH)3.
(3)比较⑦、⑧、⑨、⑩四种元素的简单离子的离子半径从大到小的顺序是S2->Cl->K+>Al 3+(用离子符号表示).
(4)⑤和③形成的A2B2型化合物的电子式为 ,属于离子化合物(填“离子化合物”还是“共价化合物”).
,属于离子化合物(填“离子化合物”还是“共价化合物”).
(5)写出能证明⑨元素的非金属性比⑧强的一个化学方程式:H2S+Cl2=2HCl+S.
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
(2)在上述元素的最高价氧化物对应水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是KOH,既能与强酸反应,又能与强碱反应的化合物的化学式是Al(OH)3.
(3)比较⑦、⑧、⑨、⑩四种元素的简单离子的离子半径从大到小的顺序是S2->Cl->K+>Al 3+(用离子符号表示).
(4)⑤和③形成的A2B2型化合物的电子式为
 ,属于离子化合物(填“离子化合物”还是“共价化合物”).
,属于离子化合物(填“离子化合物”还是“共价化合物”).(5)写出能证明⑨元素的非金属性比⑧强的一个化学方程式:H2S+Cl2=2HCl+S.
9.下列各组离子在指定溶液中可能大量共存的是( )
| A. | 通入足量SO2的溶液中:Fe2+、Na+、SO42-、ClO- | |
| B. | 常温下,c(H+)═$\sqrt{{K}_{w}}$的溶液中:Na+、Fe3+、HCO3-、K+ | |
| C. | 水电离出的c(OH-)=10-13 mol/L的溶液中:Ba2+、Cl-、NO3-、I- | |
| D. | 遇酚酞显红色的溶液中:AlO2-、HCO3-、K+、NH4+ |
19.糖类、油脂、蛋白质是维持人体生命活动所必需的三大营养物质.下列说法你认为正确的是( )
①淀粉是人体所需能量的主要来源,可以用碘水检验淀粉
②油脂可以在酸性条件下水解生成甘油和肥皂
③部分蛋白质遇到浓硝酸会变黄
④甘蔗中含有蔗糖,它和麦芽糖互为同分异构体
⑤糖类、油脂和蛋白质都能发生水解.
①淀粉是人体所需能量的主要来源,可以用碘水检验淀粉
②油脂可以在酸性条件下水解生成甘油和肥皂
③部分蛋白质遇到浓硝酸会变黄
④甘蔗中含有蔗糖,它和麦芽糖互为同分异构体
⑤糖类、油脂和蛋白质都能发生水解.
| A. | ②③④ | B. | ①③⑤ | C. | ①③④ | D. | ②④⑤ |
6.下列能发生加成反应的有机物是( )
| A. | 甲烷 | B. | 乙醇 | C. | 乙烯 | D. | 乙酸 |
3.下列有机物中属于苯的同系物的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
4.下列关于有机物的认识正确的是( )
| A. | 淀粉、油脂、蛋白质在氧气中充分燃烧,均只生成CO2和H2O | |
| B. | 分子组成为CH4和C2H6O的有机物都不存在同分异构现象 | |
| C. | 乙醇与氧气在不同条件下反应,可以得到不同产物 | |
| D. | 乙烯使溴的四氯化碳溶液褪色是因为发生了取代反应 |