题目内容
6.有A、B、C三种可溶性正盐,阴、阳离子各不相同,其阴离子的摩尔质量依次增大(按A、B、C的顺序),将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀.请回答下列问题:
(1)经检验,三种正盐中还含有下列选项中的一种离子,该离子是D.
A.Na+ B.Mg2+C.Cu2+ D.Ag+
(2)三种正盐的化学式分别是:AFeCl3,BAgNO3,CK2SO4.
(3)若将A、B、C三种正盐按一定比例溶于水后,所得溶液中只含有Fe3+、SO42-、NO3-、K+四种离子且物质的量之比依次为1:2:3:4,则A、B、C三种正盐的物质的量之比为1:3:2.
分析 等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀,A、B、C三种可溶性正盐,阴、阳离子各不相同,其阴离子的摩尔质量依次增大,则A为盐酸盐,B为硝酸银,C为硫酸盐;等物质的量混合,生成沉淀可能为AgCl,则A为FeCl3,B为AgNO3,C为K2SO4,以此来解答.
解答 解:等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀,A、B、C三种可溶性正盐,阴、阳离子各不相同,其阴离子的摩尔质量依次增大,则A为盐酸盐,B为硝酸银,C为硫酸盐;等物质的量混合,生成沉淀可能为AgCl,则A为FeCl3,B为AgNO3,C为K2SO4,
(1)所给离子中只有Ag+和SO42-、NO3-、Cl-三种阴离子中Cl-按1:1生成沉淀,其余所给阳离子均和三种阴离子不沉淀,则该离子是Ag+,
故答案为:D;
(2)由上述分析可知,A为FeCl3,B为AgNO3,C为K2SO4,故答案为:FeCl3;AgNO3;K2SO4;
(3)只含有Fe3+、SO42-、NO3-、K+四种离子且物质的量之比依次为1:2:3:4,则若FeCl3为1mol,AgNO3为3mol,二者发生Ag++Cl-═AgCl↓,K2SO4为2mol,A、B、C三种正盐的物质的量之比为1:3:2,故答案为:1:3:2.
点评 本题考查无机物的推断,为高频考点,把握三种阴离子的摩尔质量、生成AgCl的沉淀反应推断物质为解答的关键,侧重分析能力及推断能力的考查,题目难度中等.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
17.下列关于有机物的叙述正确的是( )
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 乙酸和乙酸乙酯互为同分异构体 | |
| C. | 油脂和纤维素都是能发生水解反应的高分子化合物 | |
| D. | 甲烷、苯、乙醇、乙酸和酯类都可以发生取代反应 |
14.下列离子方程式正确的是( )
| A. | 二氧化锰和浓盐酸反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2Cl2↑+2H2O | |
| B. | 稀盐酸和硅酸钠溶液反应:SiO32-+2H+═H2SiO3↓ | |
| C. | 碳酸钙和稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 铜和氯化铁溶液反应:Fe3++Cu═Fe2++Cu2+ |
1.下列对应的图象符合描述的是( )
| A. | 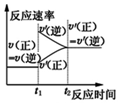 对于达到平衡状态的N2(g)+3H2(g)?2NH3(g)反应,在t1时缩小容器体积,并在t2时又达到平衡 | |
| B. | 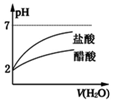 将pH=2的盐酸和醋酸分别加水稀释 | |
| C. | 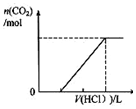 表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol•L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 | |
| D. | 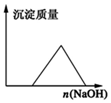 在AlCl3溶液中滴入NaOH溶液至过量 |
11.关于常温下pH均为12的氨水和氢氧化钠溶液,下列说法正确的是( )
| A. | 氨水的物质的量浓度等于氢氧化钠溶液 | |
| B. | 将氨水体积稀释10倍,pH<11 | |
| C. | 等体积氨水和氢氧化钠溶液与足量氯化铁溶液反应,氨水产生的沉淀多 | |
| D. | 将等体积的氨水和氢氧化钠用稀盐酸完全中和,消耗盐酸的体积相同 |
18.下列关于仪器使用的说法不正确的是( )
| A. | 酸碱中和滴定实验中,锥形瓶用蒸馏水洗涤后,不需要干燥 | |
| B. | 在量取液体后,量筒中残留的液体要用蒸馏水洗涤并转入相应容器 | |
| C. | 在测量或监测温度时,温度计水银球不能碰到容器内璧或底部 | |
| D. | 分液漏斗使用前需要检漏,确认不漏水后方可使用 |
5.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 由2H和18O所组成的水22g,其中所含的中子数为11 NA | |
| B. | 分子数为NA的N2、CO混合气体体积为22.4 L,质量为28 g | |
| C. | 标准状况下,22.4LNO和11.2L O2混合后气体的原子总数为3NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
 ,其中含有的化学键类型为离子键和共价键.
,其中含有的化学键类型为离子键和共价键.