题目内容
16.下列各项叙述中正确的是( )| A. | 电子层序数越大,s原子轨道的形状相同、半径越大 | |
| B. | 在同一电子层上运动的电子,其自旋方向肯定不同 | |
| C. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| D. | 原子最外层电子排布是5s1的元素,其氢氧化物不能使氢氧化铝溶解 |
分析 A、原子轨道的形状与电子层数的多少无关;
B、同一电子层上运动的电子,其自旋方向有可能相同,如2p能级只容纳2个电子,自旋方向相同;
C、基态转化成激发态要吸收能量;
D、如Rb原子最外层电子排布为5sl,RbOH为强碱,能溶解Al(OH)3.
解答 解:A、原子轨道的形状与电子层数的多少无关,s原子轨道的形状均为球形,只是半径大小不同,故A正确;
B、同一原子轨道上运动的两个电子,自旋方向肯定不同;但同一电子层上运动的电子,其自旋方向有可能相同,如2p能级只容纳2个电子,自旋方向相同,故B错误;
C、基态转化成激发态要吸收能量,则镁原子由1s22s22p63s2→1s22s22p63p2时,原子吸收能量,由基态转化成激发态,故C错误;
D、Rb原子最外层电子排布为5sl,Rb为第IA族的金属元素,其氢氧化物的碱性大于KOH,则RbOH为强碱,能溶解Al(OH)3,故D错误.
故选:A.
点评 本题考查核外电子排布规律、原子结构与元素性质等,难度中等,注意基础知识的理解掌握.

练习册系列答案
相关题目
6.某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
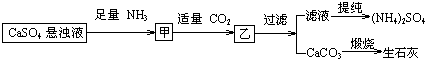
下列推断不合理的是( )

下列推断不合理的是( )
| A. | 通入CO2和NH3顺序可以颠倒 | |
| B. | 通入的NH3必须过量 | |
| C. | CO2可被循环使用 | |
| D. | 生成1mol(NH4)2SO4至少消耗2 mol NH3 |
8.某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,则至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器(填序号)abe.
Ⅱ.测定中和热的实验装置如图所示

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值57.3kJ/mol):NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如表.
①请填写下表中的空白:
②近似认为0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-53.5 kJ/mol(取小数点后一位).
③上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,则至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器(填序号)abe.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值57.3kJ/mol):NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如表.
①请填写下表中的空白:
| 实验次数 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
5.下列关于高分子化合物的叙述正确的是( )
| A. | 高分子化合物结构复杂,相对分子质量很大 | |
| B. | 对于一块高分子材料来说,n是一个整数,因而它的相对分子质量是确定的 | |
| C. | 高分子化合物是纯净物 | |
| D. | 高分子材料可分为天然高分子材料和合成高分子材料 |
6. 对于mA(s)+nB(g)?pC(g)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
对于mA(s)+nB(g)?pC(g)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
 对于mA(s)+nB(g)?pC(g)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
对于mA(s)+nB(g)?pC(g)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )| A. | m+n<p | B. | n>p | ||
| C. | x点的状态是v正>v逆 | D. | 以上答案都错误 |
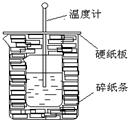 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: