题目内容
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
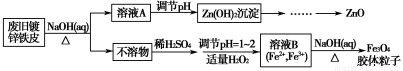
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有________。
A.去除油污 B.溶解镀锌层 C.去除铁锈 D.钝化
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是______________________________________________________________。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是_________________________________________________________。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________g K2Cr2O7(保留4位有效数字,已知MK2Cr2O7=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。
①电子天平;②烧杯;③量筒;④玻璃棒;⑤容量瓶;⑥胶头滴管;⑦移液管
(5)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将________(填“偏大”“偏小”或“不变”)。
(1)AB
(2)抽滤或过滤、洗涤、灼烧
(3)N2气氛下,防止Fe2+被氧化
(4)0.735 0 ③⑦
(5)偏大
【解析】(1)由于Zn的性质与Al的相似,可溶于NaOH溶液,因此用NaOH溶液处理废旧镀锌铁皮,除去表面的油污后,可将镀层锌溶解。
(2)调节溶液A的pH产生Zn(OH)2沉淀,然后过滤、洗涤、灼烧使Zn(OH)2分解为ZnO。考虑Zn(OH)2与Al(OH)3的性质相似,应为絮状沉淀物,过滤速度较慢,这里可采用抽滤,加快过滤速度。
(3)溶液B中含有Fe2+、Fe3+,加入NaOH溶液、加热,可得Fe3O4胶体粒子,其中Fe2+极易被氧化成Fe3+,持续通入N2的目的是防止Fe2+被氧化。
(4)称取K2Cr2O7的质量为m(K2Cr2O7)=0.010 00 mol·L-1×0.250 0 L×294.0 g·mol-1=0.735 0 g。用固体配制溶液,要用电子天平称量固体质量,并在烧杯中溶解,然后转移到容量瓶中,不需要量取液体的量筒和移液管。
(5)若滴定前装有K2Cr2O7溶液的滴定管尖嘴部分有气泡,滴定结束时气泡消失,则滴定过程中读取K2Cr2O7溶液的体积偏大,测得Fe3O4中二价铁的含量偏大。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用如图所示装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如表所示。
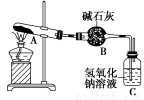
装置 | A(试管+粉末) | B | C |
反应前 | 42.0 g | 75.0 g | 140.0 g |
反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是( )
A.4CuSO4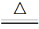 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
B.3CuSO4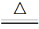 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑
C.5CuSO4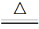 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑
D.6CuSO4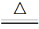 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/10-12 m | 160 | 110 | 70 | 66 |
主要化合价 | +2 | +5、+3、-3 | +5、+3、-3
| -2 |
下列叙述正确的是( )
A.离子半径:W2-<X2+
B.气态氢化物的稳定性:Z>W
C.化合物X3Z2中既含有离子键又含有共价键
D.最高价氧化物对应水化物的酸性:Z>Y