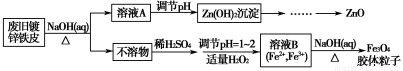
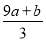题目内容
“氢能”是人类未来最理想的新能源之一。
(1)实验测得,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为__________________________。
(2)利用核能把水分解制氢气,是目前正研究的课题。如图是其中的一种流程,流程中用了过量的碘(提示:反应②的产物是O2、SO2和H2O)。
完成下列反应的化学方程式:反应①________________;反应②________________。此法制取氢气的最大优点是____________________。
(1)H2(g)+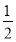 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
(2)SO2+I2+2H2O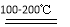 2HI+H2SO4
2HI+H2SO4
2H2SO4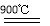 2SO2↑+O2↑+2H2O SO2和I2可循环使用,无污染
2SO2↑+O2↑+2H2O SO2和I2可循环使用,无污染
【解析】(1)表示氢气燃烧热的热化学方程式中氢气的化学计量数是1,其反应热是-142.9×2 kJ·mol-1,则其热化学方程式为H2(g)+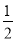 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1。
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1。
(2)据图知反应①、②分别为SO2+I2+2H2O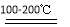 2HI+H2SO4、
2HI+H2SO4、
2H2SO4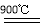 2SO2↑+O2↑+2H2O,该法制取氢气的最大优点是原料SO2和I2可循环使用,无污染。ΔH<0;②因为反应物CO和H2均有还原性,故通入少量CO2会抑制其还原,从而有利于维持催化剂Cu2O的量不变。
2SO2↑+O2↑+2H2O,该法制取氢气的最大优点是原料SO2和I2可循环使用,无污染。ΔH<0;②因为反应物CO和H2均有还原性,故通入少量CO2会抑制其还原,从而有利于维持催化剂Cu2O的量不变。

 53随堂测系列答案
53随堂测系列答案化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。
请回答下列问题:
 (1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)??
(1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)??
CH3CH2OH(g)+H2O(g)。请写出该反应的化学平衡常数表达式K=________。
(2)常温下,浓度均为0.1 mol·L-1的六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
①上述盐溶液中的阴离子,结合质子能力最强的是________。
②根据表中数据,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是________(填字母);将各溶液分别稀释100倍,pH变化最小的是________(填字母)。
A.HCN B.HClO C.H2SO4 D.CH3COOH E.H2CO3
③把CO2气体通入饱和碳酸钠溶液中,可以观察到的现象为________,原因为________(用离子方程式表示)。
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为____________。
(3)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是_______。

A.加入适量BaCl2(固体)可以使溶液由d点变到c点
B.通过加水稀释可以使溶液由b点变到a点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp等于c点对应的Ksp