题目内容
12.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )| A. | 加入少量较浓的硫酸 | B. | 加入几滴CuSO4溶液 | ||
| C. | 加入CH3COONa固体 | D. | 不用铁片,改用铁粉 |
分析 加快生成氢气的速率,可增大浓度,升高温度,增大固体的表面积以及形成原电池反应,以此解答.
解答 解:A.加入少量较浓的硫酸,氢离子浓度增大,反应速率增大,故A不选;
B.滴加少量CuSO4溶液,铁置换出铜,形成铜铁原电池,反应速率增大,故B不选;
C.加入CH3COONa固体,生成醋酸,氢离子浓度减小,反应速率减小,故C选;
D.不用铁片,改用铁粉,固体表面积增大,反应速率增大,故D不选.
故选C.
点评 本题考查化学反应速率的影响因素,侧重于基本概念的理解和应用,为高考常见题型和高频考点,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
16.在2L恒容容器中投入2mol X(g)、4mol Y发生如下反应:X(g)+Y(?)?3Z(g).测得X物质的量与时间关系如下表所示:下列说法正确的是( )
| 时间/min | 1 | 2 | 4 | 6 | 8 |
| X物质的量/mol | 1.5 | 1.2 | 1.0 | 0.9 | 0.9 |
| A. | 增加Y的质量,反应速率一定加快 | |
| B. | 0~4min段Z的平均速度为$\frac{3}{8}$mol•L-1•min-1 | |
| C. | 2~4min段X的平均速度为$\frac{1}{10}$mol•L-1•min-1 | |
| D. | X、Y的反应速率一定相等 |
3.实验室中用苯甲醛制备苯甲醇和苯甲酸.
已知:①制备原理为:
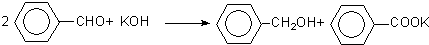
②有关物质的性质如表:
③醛可以与饱和NaHSO3溶液反应生成难溶于有机物而易溶于水的钠盐.
④纯净的液态有机物一般都有固定沸点.
制备苯甲醇和苯甲酸的主要过程如图:

(1)操作I的名称是分液.操作II的名称是蒸馏.
(2)操作III的名称是过滤,产品乙是苯甲酸.
(3)某同学测定产品甲的沸点,发现其在190℃即开始沸腾.该同学推测产品甲是苯甲醇与苯甲醛的混合物,设计了如下方案进行检验和提纯,结果表明推测正确.请在答题卡上完成表中内容.
(4)纯度测定:称取7.00g产品甲,加入足量银氨溶液充分反应,生成单质Ag 2.16g.则产品甲中苯甲醇的质量分数的计算表达式为:$\frac{7.00g-\frac{2.16g}{108g/mol}×\frac{1}{2}×106g/mol}{7.00g}$100%,
计算结果为84.9%(保留三个有效数字.苯甲醛相对分子质量:106;Ag:108).
已知:①制备原理为:

②有关物质的性质如表:
| 物质 | 沸点 | 熔点 | 溶解性 |
| 苯甲醛 | 179℃ | -26℃ | 微溶于水,能与乙醚混溶. |
| 苯甲醇 | 205.3℃ | -15.3℃ | 稍溶于水,能与乙醚混溶 |
| 苯甲酸 | 249℃ | 122℃ | 微溶于水,易溶于乙醚. |
| 乙醚 | 34.8℃ | 难溶于水 |
④纯净的液态有机物一般都有固定沸点.
制备苯甲醇和苯甲酸的主要过程如图:

(1)操作I的名称是分液.操作II的名称是蒸馏.
(2)操作III的名称是过滤,产品乙是苯甲酸.
(3)某同学测定产品甲的沸点,发现其在190℃即开始沸腾.该同学推测产品甲是苯甲醇与苯甲醛的混合物,设计了如下方案进行检验和提纯,结果表明推测正确.请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| 步骤① | 取少量产品甲于洁净的试管中,再加入2mLAg(NH3)OH 溶液,水浴加热. | 试管内壁产生光亮银镜 | 产品甲中含有苯甲醛 |
| 步骤② | 将少量产品甲置于分液漏斗中,然后向漏斗中加入饱和NaHSO3溶液,溶液,充分反应后分液. | ||
| 步骤③ | 将步骤②的有机层洗涤、干燥后,测定产品的 沸点 | 沸点为205.3℃ | 所得有机层是纯净的苯甲醇 |
计算结果为84.9%(保留三个有效数字.苯甲醛相对分子质量:106;Ag:108).
17.下列实验操作或记录正确的是( )
| A. | 用两只250 mL的容量瓶配制0.1 mol/L 500 mL的NaOH溶液 | |
| B. | 用量筒测得排水法收集制得的氢气体积为50.28 mL | |
| C. | 常温常压下测得1 mol N2的质量为28 g | |
| D. | 用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g |
4.一种从植物中提取的天然化合物α-damascone可用于制作香水,其结构为: ,有关该化合物的下列说法不正确的是( )
,有关该化合物的下列说法不正确的是( )
 ,有关该化合物的下列说法不正确的是( )
,有关该化合物的下列说法不正确的是( )| A. | 分子式为C13H20O | |
| B. | 该化合物中含有一个手性碳原子 | |
| C. | 1 mol该化合物完全燃烧消耗18 mol O2 | |
| D. | 所有碳原子可能在一个平面上 |
1.关于取代反应和置换反应的下列说法中,正确的是( )
| A. | 取代反应和置换反应中一定都有单质生成 | |
| B. | 取代反应的反应物一定都是有机物,置换反应的反应物一定都是无机物 | |
| C. | 取代反应大多是可逆的,反应速率慢,而置换反应一般是单向进行的,反应速率快 | |
| D. | 取代反应和置换反应的产物都是唯一的,不会有多种产物并存的现象 |
2.用钠熔法可定性确定有机物中是否存在氯、溴、硫、氮等元素.下列有关有机物与足量钠反应,各元素的转化结果正确的是( )
| A. | 碳元素转化为NaCN | B. | 氯元素转化为高氯酸钠 | ||
| C. | 溴元素转化为溴化钠 | D. | 硫元素转化为硫酸钠 |