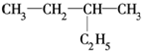题目内容
某无色溶液,其中有可能存在离子如下:Na+、Ba2+、Al3+、A1O2-、S2-、SO
、SO
.现取该溶液进行有关实验,实验结果如图所示.

请回答下列问题:
(1)沉淀甲是
(2)沉淀乙是 由溶液甲生成沉淀乙的离子方程式为:
(3)沉淀丙是
(4)写出生成甲的离子方程式
(5)综合上述信息,可以肯定存在的离子 .
2- 3 |
2- 4 |

请回答下列问题:
(1)沉淀甲是
(2)沉淀乙是
(3)沉淀丙是
(4)写出生成甲的离子方程式
(5)综合上述信息,可以肯定存在的离子
考点:常见离子的检验方法,离子方程式的书写
专题:离子反应专题
分析:由无色溶液加HBr产生淡黄色沉淀,则沉淀甲为S,则发生2S2-+SO32-+6H+=3S↓+3H2O,一定存在S2-、SO32-;溶液甲与过量碳酸氢铵反应,则沉淀乙为Al(OH)3,气体乙为二氧化碳,溶液乙中加过量氢氧化钡反应生成白色沉淀丙应为BaCO3,气体丙为氨气,然后结合离子的共存来分析.
解答:
解:由无色溶液加HBr产生淡黄色沉淀,则沉淀甲为S,则发生2S2-+SO32-+6H+=3S↓+3H2O,一定存在S2-、SO32-;溶液甲与过量碳酸氢铵反应,则沉淀乙为Al(OH)3,气体乙为二氧化碳,溶液乙中加过量氢氧化钡反应生成白色沉淀丙应为BaCO3,气体丙为氨气,Ag+、Ba2+、Al3+与S2-、SO32-不能共存,则不存在,由电荷守恒可知,一定存在的阳离子为Na+,一定存在的阴离子为S2-、SO32-、AlO2-,
(1)由上述分析可知,沉淀甲为S,生成沉淀的离子反应为2S2-+SO32-+6H+=3S↓+3H2O,
故答案为:S;
(2)沉淀乙为Al(OH)3,生成沉淀乙的离子反应为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al(OH)3; Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)原溶液中有可能有硫酸根离子,溶液乙中含碳酸氢根离子,则沉淀丙为BaCO3,可能有BaSO4,在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3 外还有BaSO4;若全部溶解,则仅有BaCO3,
故答案为:BaCO3,可能有BaSO4;
(4)沉淀甲为S,生成沉淀的离子反应为:2S2-+SO32-+6H+=3S↓+3H2O,
故答案为:2S2-+SO32-+6H+=3S↓+3H2O;
(5)根据以上分析可知,肯定存在的离子有:Na+、S2-、SO32-、AlO2-,
故答案为:Na+、S2-、SO32-、AlO2-.
(1)由上述分析可知,沉淀甲为S,生成沉淀的离子反应为2S2-+SO32-+6H+=3S↓+3H2O,
故答案为:S;
(2)沉淀乙为Al(OH)3,生成沉淀乙的离子反应为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al(OH)3; Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)原溶液中有可能有硫酸根离子,溶液乙中含碳酸氢根离子,则沉淀丙为BaCO3,可能有BaSO4,在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3 外还有BaSO4;若全部溶解,则仅有BaCO3,
故答案为:BaCO3,可能有BaSO4;
(4)沉淀甲为S,生成沉淀的离子反应为:2S2-+SO32-+6H+=3S↓+3H2O,
故答案为:2S2-+SO32-+6H+=3S↓+3H2O;
(5)根据以上分析可知,肯定存在的离子有:Na+、S2-、SO32-、AlO2-,
故答案为:Na+、S2-、SO32-、AlO2-.
点评:本题考查离子的共存及离子反应,利用流程及离子之间的反应推断出存在离子是解答的关键,注意过量离子及电荷守恒的应用,题目难度中等.

练习册系列答案
相关题目
下列化合物中,只有在溶液中才能导电的电解质是( )
| A、NaCl |
| B、酒精 |
| C、H2SO4 |
| D、KCl |
下列垃圾中,不适合用卫生填埋、焚烧、堆肥等处理方法处理的是( )
| A、剩菜剩饭 | B、纯棉纺织品 |
| C、卫生纸 | D、电池 |
某科研机构发现了一种环烷烃,因其外形酷似一个“十”字,而被命名为“红十字烷”,已知其结构 ,则它的一氯代物有( )
,则它的一氯代物有( )
 ,则它的一氯代物有( )
,则它的一氯代物有( )| A、2种 | B、3种 | C、4种 | D、5种 |
 和
和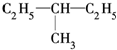 E.
E.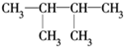 和
和