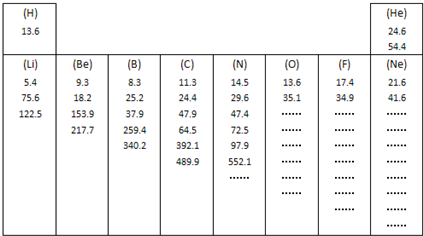
题目内容
重氧(18O)是氧元素的一种放射性同位素,下列说法正确的是
A.Na2O2与H218O反应时生成18O2气体
B.向2SO2(g)+O2(g) 2SO3(g)的平衡体系中加入18O2,结果18O只出现在SO3中
2SO3(g)的平衡体系中加入18O2,结果18O只出现在SO3中
C.CH3COOH和CH3CH218OH发生酯化反应时,产物水的分子式为H218O
D.用惰性电极电解含有H218O的水时,阳极会产生三种相对分子质量不同的氧分子
【答案】
D
【解析】
试题分析:A、过氧化钠与CO2的反应中,过氧化钠既是氧化剂,也是还原剂,氧气是氧化产物,所以Na2O2与H218O反应时得不到18O2气体,A不正确;B、由于该反应是可逆反应,在生成三氧化硫的同时,三氧化硫也分解生成二氧化硫和氧气,因此三种物质中均存在18O,B不正确;C、在酯化反应中羧酸提供羟基,醇提供氢原子,因此CH3COOH和CH3CH218OH发生酯化反应时,18O不出现在产物水的分子中,C不正确;D、用惰性电极电解含有H218O的水时,阳极会产生三种相对分子质量不同的氧分子,分别是32、34、36,D正确,答案选D。
考点:考查过氧化钠、可逆反应、酯化反应以及电解原理的有关判断等

练习册系列答案
相关题目
Na2O和Na2O2是钠元素的两种重要氧化物,下列关于Na2O和Na2O2的比较中,不正确的是( )
| A、Na2O2、Na2O都属于碱性氧化物 | B、Na2O、Na2O2与水反应后溶液都显碱性 | C、Na2O、Na2O2与CO2反应都有Na2CO3生成 | D、Na2O2可用作供氧剂,Na2O不能做供氧剂 |
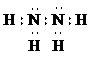
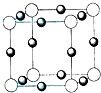 (2011?平顶山二模)A、B、C、D、E五种前四周期元素,原子序数依次增大.已知D元素原子核外的M层上有3个单电子存在.在周期表中,B、E与D同主族,A、C分别与B、D处于相邻位置.回答下列问题:
(2011?平顶山二模)A、B、C、D、E五种前四周期元素,原子序数依次增大.已知D元素原子核外的M层上有3个单电子存在.在周期表中,B、E与D同主族,A、C分别与B、D处于相邻位置.回答下列问题: