题目内容
 (2011?平顶山二模)A、B、C、D、E五种前四周期元素,原子序数依次增大.已知D元素原子核外的M层上有3个单电子存在.在周期表中,B、E与D同主族,A、C分别与B、D处于相邻位置.回答下列问题:
(2011?平顶山二模)A、B、C、D、E五种前四周期元素,原子序数依次增大.已知D元素原子核外的M层上有3个单电子存在.在周期表中,B、E与D同主族,A、C分别与B、D处于相邻位置.回答下列问题:(1)元素E的元素符号为
As
As
,最高正价为+5
+5
,最外层电子构型为4s24p3
4s24p3
;(2)C的常见氯化物中,C元素的杂化类型为
sp3
sp3
,A元素在其含氧酸根离子中的杂化类型为sp2
sp2
,A、C两元素所形成化合物的晶体类型是原子晶体
原子晶体
;(3)D的氢化物的立体结构呈
三角锥
三角锥
型,该氢化物比元素B的氢化物沸点低的原因是B元素的氢化物之间存在有氢键
B元素的氢化物之间存在有氢键
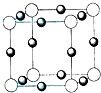
.(4)元素B的离子(B3-)与某金属离子(X+)形成化合物的晶胞结构如图所示.则晶胞中顶点上的小球应代表
B3-
B3-
(填“B3-”或“X+”).分析:D元素原子核外的M层上有3个单电子,应为P元素,为第ⅤA族Ⅳ元素,在周期表中,B、E与D同主族,且原子序数E大于B,则B为N元素,E为As元素,A、C分别与B、D处于相邻位置,且A、B、C、D、E五种前四周期元素,原子序数依次增大,则A为C元素,C为Si元素,以此解答该题.
解答:解:D元素原子核外的M层上有3个单电子,应为P元素,为第ⅤA族Ⅳ元素,在周期表中,B、E与D同主族,且原子序数E大于B,则B为N元素,E为As元素,A、C分别与B、D处于相邻位置,且A、B、C、D、E五种前四周期元素,原子序数依次增大,则A为C元素,C为Si元素,
(1)E为As元素,最外层电子数为5,最高化合价为+5价,最外层电子构型为4s24p3,故答案为:As;+5;4s24p3;
(2)C的常见氯化物SiCl4,Si的价层电子对为4,无孤电子对,杂化类型为sp3,A元素在其含氧酸根离子为CO32-,C原子形成3个δ键,孤电子对为
= 0,则价层电子对为3,所以杂化类型为sp2,A、C两元素所形成化合物SiC,为原子晶体,故答案为:sp3;sp2;原子晶体;
(3)D的氢化物为PH3,分子中P与O形成3个δ键,孤电子对数位
= 1,价层电子对为4,则分子的立体构型为三角锥形,因NH3中含有氢键,则PH3沸点低于NH3,
故答案为:三角锥;B元素的氢化物之间存在有氢键;
(4)根据化合价可知,元素B的离子(B3-)与某金属离子(X+)形成化合物应为X3B,晶胞中的离子有两种物质,位于顶点的离子数为:8×
=1,位于面心的离子数目为:6×
=3,
由化学式可知,位于顶点的离子为B3-,故答案为:B3-.
(1)E为As元素,最外层电子数为5,最高化合价为+5价,最外层电子构型为4s24p3,故答案为:As;+5;4s24p3;
(2)C的常见氯化物SiCl4,Si的价层电子对为4,无孤电子对,杂化类型为sp3,A元素在其含氧酸根离子为CO32-,C原子形成3个δ键,孤电子对为
| 4+2-2×3 |
| 2 |
(3)D的氢化物为PH3,分子中P与O形成3个δ键,孤电子对数位
| 5-3×1 |
| 2 |
故答案为:三角锥;B元素的氢化物之间存在有氢键;
(4)根据化合价可知,元素B的离子(B3-)与某金属离子(X+)形成化合物应为X3B,晶胞中的离子有两种物质,位于顶点的离子数为:8×
| 1 |
| 8 |
| 1 |
| 2 |
由化学式可知,位于顶点的离子为B3-,故答案为:B3-.
点评:本题考查元素的推断,较为综合,涉及杂化类型、分子构型以及晶胞的计算等问题,题目难度较大,注意正确推断元素的种类为解答本题的关键.

练习册系列答案
相关题目
 (2011?平顶山二模)石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
(2011?平顶山二模)石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( ) 2CH3OH+3O2+4OH-,则下列说法正确的是( )
2CH3OH+3O2+4OH-,则下列说法正确的是( )