题目内容
2.乙苯催化脱氢制苯乙烯反应: 已知:1mol C-H键完全断裂时吸收热量412kJ,1mol C-C键完全断裂时吸收热量348kJ1mol C=C键完全断裂吸收热量612kJ,1mol H-H键完全断裂时吸收热量436kJ.上述反应的△H等于( ) kJ•mol-1.
已知:1mol C-H键完全断裂时吸收热量412kJ,1mol C-C键完全断裂时吸收热量348kJ1mol C=C键完全断裂吸收热量612kJ,1mol H-H键完全断裂时吸收热量436kJ.上述反应的△H等于( ) kJ•mol-1.| A. | -124 | B. | +124 | C. | -288 | D. | +288 |
分析 反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差.
解答 解:反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,故△H=(5×412+348-3×412-612-436)kJ•mol-1=+124kJ•mol-1,
故选:B.
点评 本题考查反应热计算,利用反应热=反应物总键能-生成物总能键能,题目难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
12. 碳的氧化物在工业上有着广泛的应用,如CO 和H2可以合成甲醇,CO2 和NH3可以合成尿素.
碳的氧化物在工业上有着广泛的应用,如CO 和H2可以合成甲醇,CO2 和NH3可以合成尿素.
若在20L的密闭容器中按物质的量之比1:2充入CO和H2,发生反应:
CO(g)+2H2(g)═CH3OH(g).测得平衡时CO得转化率随温度变化及压强的变化如图所示:p2、195℃时,n(H2)随时间的变化如表所示:
(1)p2、195℃时,0~1min内,υ(H2)=0.15mol/(L•min).
(2)你认为p1< p2; p2、195℃时,B点,υ正<υ逆.(填“<”“>”或“=”)
(3)p2、195℃时,该反应的化学平衡常数为25.
 碳的氧化物在工业上有着广泛的应用,如CO 和H2可以合成甲醇,CO2 和NH3可以合成尿素.
碳的氧化物在工业上有着广泛的应用,如CO 和H2可以合成甲醇,CO2 和NH3可以合成尿素.若在20L的密闭容器中按物质的量之比1:2充入CO和H2,发生反应:
CO(g)+2H2(g)═CH3OH(g).测得平衡时CO得转化率随温度变化及压强的变化如图所示:p2、195℃时,n(H2)随时间的变化如表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
(2)你认为p1< p2; p2、195℃时,B点,υ正<υ逆.(填“<”“>”或“=”)
(3)p2、195℃时,该反应的化学平衡常数为25.
13.下列关于混合物、纯净物、电解质和非电解质的正确组合是( )
| 净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
| B | 冰醋酸 | 漂白粉 | 硫酸钡 | 二氧化硫 |
| C | 石墨 | 空气 | 苛性钾 | 碳酸钙 |
| D | 浓硫酸 | 氨水 | 氯化钠 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
10.关于化学反应的说法中错误的是( )
| A. | 如图所示的反应为放热反应 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 化学反应具有方向性 | |
| D. | 化学键断裂吸收能量,化学键生成放出能量 |
17. 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )| A. | 氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 电镀工业中,X是待镀金属,Y是镀层金属 | |
| D. | 外加电流的阴极保护法中,Y是待保护金属 |
14.下列的离子方程式正确的是( )
| A. | 用大理石跟稀盐酸制二氧化碳:CO32-+2H+═H2O+CO2↑ | |
| B. | 向氢氧化钡溶液中加硫酸溶液:SO42-+Ba2+=BaSO4↓ | |
| C. | 硫酸溶液中加入Mg (OH)2:2H++2OH-=2H2O | |
| D. | 澄清石灰水与盐酸的反应:H++OH-=H2O |
11.反应X (s)+3Y(g)=4Z(g)+5M(g) 在5L密闭容器中进行,30秒后,Z的物质的量增加了3mol,则此反应的平均速率v(表示反应物的消耗速率或生成物的生成速率)为( )
| A. | v(X)=0.005 mol•L-1•s-1 | B. | v(Z)=0.01 mol•L-1•s-1 | ||
| C. | v(Y)=0.01 mol•L-1•s-1 | D. | v(M)=0.025 mol•L-1•s-1 |
12.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯、甲苯均不能使酸性KMnO,溶液褪色 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | C4H10有三种同分异构体 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
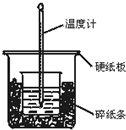 通过测定反应过程中所放出的热量可计算中和热.50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:
通过测定反应过程中所放出的热量可计算中和热.50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题: