题目内容
9.氯气和氯乙烯都是非常重要的化工产品,年产量均在107 t左右.氯气的实验室制备和氯乙烯的工业生产都有多种不同方法.完成下列填空:(1)实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸.还需要饱和氯化钠溶液、氢氧化钠溶液(填写试剂或溶液名称).
(2)实验室用2.00mol/L盐酸和漂粉精(成分为Ca(ClO)2、CaCl2)反应生成氯气、氯化钙和水,若产生2.24L(标准状况)氯气,发生反应的盐酸100mL.
(3)实验室通常用向上排空气法收集氯气.设计一个简单实验,验证所收集的氯气中是否含有空气.用试管收集氯气,收集满后将试管倒立在氢氧化钠溶液中,观察试管内有无残留气体
(4)工业上用电石-乙炔法生产氯乙烯的反应如下:
CaO+3C$\stackrel{2200℃-2300℃}{→}$CaC2+CO;CaC2+2H2O→HC≡CH↑+Ca(OH)2;HC≡CH+HCl$→_{140℃-200℃}^{HgCl_{2}}$CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖于石油资源.电石-乙炔法的缺点是:高耗能 会污染环境.
分析 (1)依据浓盐酸具有挥发性,制取的氯气中含有水蒸气和氯化氢,要想制取纯净的氯气需要除去氯化氢和水蒸气,氯气有毒,过量的氯气应进行尾气处理;
(2)依据反应方程式:ClO-+Cl-+2H+=Cl2↑+H2O计算解答;
(3)氯气可与氢氧化钠溶液反应,如含有空气,则与氢氧化钠反应后试管内有残留气体;
(4)依据反应流程判断,此方法缺点:高能耗、会污染环境、使用有毒的原料不符合绿色化学等.
解答 解:(1)浓盐酸具有挥发性,制取的氯气中含有水蒸气和氯化氢,要想制取纯净的氯气需要除去氯化氢和水蒸气,应依次通过盛有饱和食盐水的洗气瓶、浓硫酸的洗气瓶,氯气有毒,不能直接排放到空气中,氯气能够与氢氧化钠反应,可以用氢氧化钠吸收过量的氯气,所以除了二氧化锰、浓盐酸和浓硫酸,还需要:
饱和氯化钠溶液、氢氧化钠溶液;
故答案为:饱和氯化钠溶液、氢氧化钠溶液;
(2)2.24L氯气的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,反应的离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O,生成0.1mol氯气需要消耗盐酸的物质的量为0.2mol,消耗盐酸的体积为$\frac{0.2mol}{2mol/L}$=0.1L,即100mL;
故答案为:100;
(3)氯气可与氢氧化钠溶液反应,如含有空气,则与氢氧化钠反应后试管内有残留气体,所以检验方法为:用试管收集氯气,收集满后将试管倒立在氢氧化钠溶液中,观察试管内有无残留气体;
故答案为:用试管收集氯气,收集满后将试管倒立在氢氧化钠溶液中,观察试管内有无残留气体;
(4)依据反应流程判断,此方法缺点在于:高能耗、会污染环境、使用有毒的原料不符合绿色化学,
故答案为:高耗能 会污染环境.
点评 本题考查氯气的制备和性质的检验,熟悉氯气制备原理是解题关键,题目难度不大.

| A. | 262.6kJ/mol | B. | -131.3kJ/mol | C. | -352.3kJ/mol | D. | +131.3kJ/mol |
①0.3molNH3
②标准状况下的22.4L氯气
③9mLH2O(4℃)
④0.2mol磷酸.
| A. | ①④③② | B. | ④③②① | C. | ②④③① | D. | ①④②③ |
| A. | A一定不是气态物质 | B. | A一定是气态物质 | ||
| C. | B一定不是气态物质 | D. | B一定是气态物质 |
C2H4(g)+H2O(g)=C2H5OH(g)△H=-45.8kJ/mol
则下列说法中正确的是( )
| A. | 实验中,乙烯的用量不会影响该反应的反应焓变△H | |
| B. | 0.5 mol H2O(l) 完全反应放出的热量为22.9 kJ | |
| C. | 1 mol C2H5OH(g)具有的能量大于1 mol C2H4(g)和1 mol H2O (g)所具有的能量和 | |
| D. | 1 mol C2H4(g)和1 mol H2O (g)中化学键的总键能大于1 mol C2H5OH(g)中化学键的总键能 |

 .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. .
.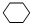 ,名称是环己烷,该烃的二氯代物有4种.
,名称是环己烷,该烃的二氯代物有4种.