题目内容
将6.50g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应.求:
(1)6.50g锌的物质的量为多少?
(2)反应中生成的H2在标准状况下的体积为多少?
(3)所用盐酸中HCl的物质的量浓度为多少?
(1)6.50g锌的物质的量为多少?
(2)反应中生成的H2在标准状况下的体积为多少?
(3)所用盐酸中HCl的物质的量浓度为多少?
考点:化学方程式的有关计算
专题:
分析:(1)根据n=
计算6.50g锌的物质的量;
(2)根据方程式计算生成氢气的物质的量,再根据V=nVm计算氢气的体积;
(3)根据方程式Zn+2HCl=ZnCl2+H2↑,计算HCl的物质的量,再根据c=
计算盐酸的物质的量浓度.
| m |
| M |
(2)根据方程式计算生成氢气的物质的量,再根据V=nVm计算氢气的体积;
(3)根据方程式Zn+2HCl=ZnCl2+H2↑,计算HCl的物质的量,再根据c=
| n |
| V |
解答:
解:(1)6.50g锌的物质的量为:
=0.1mol,答:6.50g锌的物质的量是0.1mol;
(2)由化学方程式Zn+2HCl=ZnCl2+H2↑可知:n(H2)=n(Zn)=0.1 mol,
所以氢气的体积为:0.1mol×22.4L/mol=2.24L,
答:反应中生成的H2在标准状况下所占的体积为2.24L;
(3)令HCl的物质的量为nmol,则:
Zn+2HCl=ZnCl2+H2↑
65g 2mol
6.5g nmol
所以
=
解得n=0.2
故该盐酸的物质的量浓度为:
=2mol/L,
答:所用盐酸中HCl中的物质的量浓度为2mol/L.
| 6.5g |
| 65g/mol |
(2)由化学方程式Zn+2HCl=ZnCl2+H2↑可知:n(H2)=n(Zn)=0.1 mol,
所以氢气的体积为:0.1mol×22.4L/mol=2.24L,
答:反应中生成的H2在标准状况下所占的体积为2.24L;
(3)令HCl的物质的量为nmol,则:
Zn+2HCl=ZnCl2+H2↑
65g 2mol
6.5g nmol
所以
| 65g |
| 6.5g |
| 2mol |
| nmol |
解得n=0.2
故该盐酸的物质的量浓度为:
| 0.2mol |
| 0.1L |
答:所用盐酸中HCl中的物质的量浓度为2mol/L.
点评:本题考查根据方程式的计算、常用化学计量的有关计算,比较基础,题目难度不大,注意对基础知识的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某同学按图所示的装置进行电解实验.下列说法正确的是( )
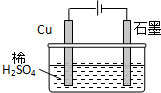

| A、电解过程中,铜电极上有H2产生 | ||||
| B、电解一定时间后,石墨电极上有H2析出 | ||||
| C、整个电解过程中,H+的浓度不断增大 | ||||
D、电解初期,主反应方程式为:Cu+H2SO4
|
甲、乙、丙为二、三周期的元素,原子序数依次增大,甲和乙同周期,甲和丙同主族,甲、乙原子序数之和与丙的原子序数相等,甲、丙原子的最外层电子数之和与乙原子的电子总数相等.下列说法中不正确的是( )
| A、乙是地壳中含量最多的元素 |
| B、丙的氢化物比甲的氢化物热稳定性强 |
| C、乙与丙形成的化合物可制作光导纤维 |
| D、甲、乙两种元素形成的化合物中可能既含离子键又含有共价键 |
实验室需配制一种强酸溶液500mL,且要求c (H+)=2mol/L,下列配制方法可行的是( )
| A、取100mL5mol/LH2SO4,加入400mL水 |
| B、取200mL5mol/LHCl,加水稀释至500mL |
| C、取100 mL5mol/LH2SO4,加水500mL |
| D、取100 mL5mol/LHNO3,加水稀释至500mL |
把Ba(OH)2溶液滴入明矾溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
| A、Al3+ |
| B、Al(OH)3 |
| C、AlO2- |
| D、Al3+和Al(OH)3 |
关于1molH2O的说法正确的是( )
| A、质量18g |
| B、体积22.4L |
| C、分子数为1 |
| D、含有O原子的物质的量为2mol |
下列关于阿伏加德罗常数的说法不正确的是( )
| A、阿伏加德罗常数是一个纯数,没有单位 |
| B、常用NA表示阿伏加德罗常数 |
| C、阿伏加德罗常数是一个实验值 |
| D、阿伏加德罗常数常用:6.02×1023mol-1 |
石灰石是许多工业的原料之一,但制取下列物质时不需用石灰石的是( )
| A、制硅 | B、制水泥 |
| C、制玻璃 | D、制生石灰 |