题目内容
现有Fe、FeO、Fe2O3和Fe3O4组成的混合物,取一定质量,加入100mL 4mol/L的盐酸,混合物恰好完全溶解,放出a mL(标准状况下)的气体,所得溶液中加入KSCN溶液无血红色出现.若取等质量的该混合物,用足量的CO还原可得铁单质的质量为( )
| A、2.8g |
| B、5.6g |
| C、8.4g |
| D、11.2 g |
考点:有关混合物反应的计算
专题:计算题
分析:盐酸恰好使混合物完全溶解,则盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeCl2溶液,根据氯元素守恒可知n(FeCl2)=
n(HCl);用足量的CO在高温下还原相同质量的混合物得到铁,根据Fe元素守恒可得:n(Fe)=n(FeCl2),再根据m=nM计算得到用足量的CO还原可得铁单质的质量.
| 1 |
| 2 |
解答:
解:盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeCl2溶液,
根据氯元素守恒可得:n(FeCl2)=
n(HCl)=
×0.1L×4mol/L=0.2mol;
用足量的CO在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知n(Fe)=n(FeCl2)=0.2mol,
0.2molFe的质量为:0.2mol×56g/mol=11.2g,
即:用足量的CO还原可得铁单质的质量为11.2g,
故选D.
根据氯元素守恒可得:n(FeCl2)=
| 1 |
| 2 |
| 1 |
| 2 |
用足量的CO在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知n(Fe)=n(FeCl2)=0.2mol,
0.2molFe的质量为:0.2mol×56g/mol=11.2g,
即:用足量的CO还原可得铁单质的质量为11.2g,
故选D.
点评:本题考查了有关混合物的计算,题目难度中等,利用元素守恒判断铁的物质的量是解题关键,注意守恒思想的运用,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
瓦斯中甲烷与氧气的体积比为1:2时极易爆炸,则此时甲烷与氧气的质量比为( )
| A、1:1 | B、2:1 |
| C、1:4 | D、4:1 |
下列说法正确的是( )
| A、中和热一定是强酸跟强碱反应放出的热量 |
| B、1 mol酸与1 mol碱完全反应放出的热量是中和热 |
| C、在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热 |
| D、测定中和热时可用稀硫酸和稀Ba(OH)2溶液 |
下列说法中正确的是( )
| A、所有主族元素中,氟的电负性最大 |
| B、钠的第一电离能比镁的第一电离能大 |
| C、第三周期所包含的元素中钠的原子半径最小 |
| D、电子云示意图中的每个小黑点都表示一个电子 |
把足量的铁粉投入稀硫酸和硫酸铜的混合溶液中,充分反应后,残留固体的质量与原来加入铁粉的质量相等,则原溶液中H+和SO42-的物质的量之比为( )
| A、1:4 | B、2:7 |
| C、1:2 | D、8:31. |
 铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成.
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成.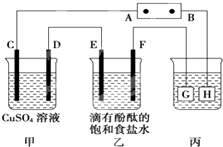 如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.