题目内容
完成下列空格
(1)室温下,0.1mol/L氨水10mL,加蒸馏水稀释到1L后,填写下列变化(填“增大、减小、不变)
电离度 n(NH4+) [H+]
(2)25℃时,向纯水中加入NaOH,使溶液的pH为11,则由水电离出的 c(OH-)为
(3)25℃时,向纯水中加入HCl,使溶液的pH为3,则由水电离出的c(H+)为
(4)某一元弱酸溶液中存在1.9×1022个弱酸分子和1.0×1021个H+,该酸的电离度为 .
(1)室温下,0.1mol/L氨水10mL,加蒸馏水稀释到1L后,填写下列变化(填“增大、减小、不变)
电离度
[N
| ||
| [NH3?H2O] |
(2)25℃时,向纯水中加入NaOH,使溶液的pH为11,则由水电离出的 c(OH-)为
(3)25℃时,向纯水中加入HCl,使溶液的pH为3,则由水电离出的c(H+)为
(4)某一元弱酸溶液中存在1.9×1022个弱酸分子和1.0×1021个H+,该酸的电离度为
考点:弱电解质在水溶液中的电离平衡,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)加水稀释促进一水合氨电离,溶液中NH4+和OH-物质的量增多,一水合氨电离增大程度小于溶液体积增大程度,导致溶液中c(NH4+)、c(OH-)、c(NH3.H2O) 减小,c(H+)增大;
(2)碱溶液中水电离出的 c(OH-) 等于溶液中c(H+);
(3)酸溶液中,水电离出的c(H+)等于溶液中 c(OH-);
(4)一元弱酸电离时,一个弱酸分子电离生成一个H+,根据H+个数计算发生电离的弱酸分子个数,再结合电离度进行计算.
(2)碱溶液中水电离出的 c(OH-) 等于溶液中c(H+);
(3)酸溶液中,水电离出的c(H+)等于溶液中 c(OH-);
(4)一元弱酸电离时,一个弱酸分子电离生成一个H+,根据H+个数计算发生电离的弱酸分子个数,再结合电离度进行计算.
解答:
解:(1)加水稀释促进一水合氨电离,所以一水合氨电离度增大,溶液中NH4+和OH-物质的量增多、一水合氨物质的量减少,所以
增大,一水合氨电离增大程度小于溶液体积增大程度,导致溶液中c(NH4+)、c(OH-)、c(NH3.H2O) 减小,温度不变,水的离子积常数不变,则c(H+)增大,
故答案为:增大; n(NH4+)增大;[H+]增大;增大;
(2)碱溶液中水电离出的 c(OH-) 等于溶液中c(H+),所以水电离出的c(OH-)=c(H+)=10-11mol/L,故答案为:10-11mol/L;
(3)酸溶液中,水电离出的c(H+)等于溶液中 c(OH-),所以水电离出的c(H+)=c(OH-)=
mol/L=10-11mol/L,故答案为:10-11mol/L;
(4)一元弱酸电离时,一个弱酸分子电离生成一个H+,所以发生电离的醋酸分子个数为1.0×1021,则醋酸电离度=
×100%=5%,
故答案为:5%.
[N
| ||
| [NH3?H2O] |
故答案为:增大; n(NH4+)增大;[H+]增大;增大;
(2)碱溶液中水电离出的 c(OH-) 等于溶液中c(H+),所以水电离出的c(OH-)=c(H+)=10-11mol/L,故答案为:10-11mol/L;
(3)酸溶液中,水电离出的c(H+)等于溶液中 c(OH-),所以水电离出的c(H+)=c(OH-)=
| 10-14 |
| 10-3 |
(4)一元弱酸电离时,一个弱酸分子电离生成一个H+,所以发生电离的醋酸分子个数为1.0×1021,则醋酸电离度=
| 1.0×1021 |
| (19+1.0)×1021 |
故答案为:5%.
点评:本题考查了弱电解质的电离及pH的简单计算,知道加水稀释氨水时各微粒浓度变化,注意酸溶液中水电离出c(H+)、碱溶液中水电离出 c(OH-)的计算方法,为易错点.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
SiCl4的分子结构与CH4类似,下列说法中不正确的是( )
| A、SiCl4具有正四面体的构型 |
| B、在SiCl4和CCl4晶体中,前者分子间作用力比后者大 |
| C、常温下SiCl4是气体 |
| D、SiCl4的分子中硅氯键的极性比CCl4中的碳氯键强 |
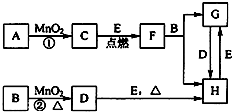 如图中所涉及的物质均为中学化学中的常见物质,其中C为单质,且为空气的主要成分之一;D为黄绿色气体;E为日常生活中应用最广泛的金属单质之一,其余为化合物.它们存在如图所示的转化关系,反应中生成的次要产物均已略去.
如图中所涉及的物质均为中学化学中的常见物质,其中C为单质,且为空气的主要成分之一;D为黄绿色气体;E为日常生活中应用最广泛的金属单质之一,其余为化合物.它们存在如图所示的转化关系,反应中生成的次要产物均已略去.