题目内容
试样X由氧化亚铁和氧化铜组成,取质量相等的两份试样按下图进行实验:

(1)请写出步聚③中发生的全部反应的离子方程式:____________________________________。
(2)要使试样X转变为粉末Z。除了CO外,还可以使用 。
(3)若全部的溶液Y和全部的粉未Z充分反应,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为(用m表示): 。

(1)请写出步聚③中发生的全部反应的离子方程式:____________________________________。
(2)要使试样X转变为粉末Z。除了CO外,还可以使用 。
| A.氢气 | B.焦炭 | C.氯气 | D.氧气 |
(1)Fe+2H+=Fe2++H2↑、Fe+Cu2+=Cu+Fe2+(各2分)
(2)AB(2分)(错无分,对1个得1分。共2分)
(3)0.625m或 m(3分)(带任何单位扣1分)
m(3分)(带任何单位扣1分)
(2)AB(2分)(错无分,对1个得1分。共2分)
(3)0.625m或
 m(3分)(带任何单位扣1分)
m(3分)(带任何单位扣1分)试题分析:(1)氧化亚铁与氧化铜分别与盐酸反应生成氯化亚铁、氯化铜,因此溶液Y中含有亚铁离子、铜离子以及过量的盐酸。因为反应CuO+CO
 Cu+CO2,FeO+CO
Cu+CO2,FeO+CO Fe+CO2 ,所以固体粉末Z为Cu和Fe。铁能和铜离子发生置换反应,所以铁和铜离子发生的离子方程式为Fe+Cu2+=Cu+Fe2+;强酸性溶液E不含铜离子,且有气体F生成,所以铁与铜离子反应后铁过量,过量的铁还和酸反应,反应的离子方程式为Fe+2H+=Fe2++H2↑。
Fe+CO2 ,所以固体粉末Z为Cu和Fe。铁能和铜离子发生置换反应,所以铁和铜离子发生的离子方程式为Fe+Cu2+=Cu+Fe2+;强酸性溶液E不含铜离子,且有气体F生成,所以铁与铜离子反应后铁过量,过量的铁还和酸反应,反应的离子方程式为Fe+2H+=Fe2++H2↑。(2)氢气与焦炭均具有还原性,能还原氧化亚铁与氧化铜,AB正确;氯气与氧气均具有强氧化性,不能还原金属氧化物,CD不正确,答案选AB。
(3)不溶物W为铜,铜有两部分来源,一部分是CO还原出的铜,一部分为铁与铜离子反应置换出的铜,所以以W的一半计算试样中的氧化铜的质量,则根据原子守恒可知
CuO~~~~~Cu
80 64
 m m
m m所以试样中氧化铜的质量为
 m×
m× =
= m
m
练习册系列答案
 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
 B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接; 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。
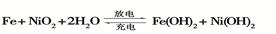
 的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题: 、Cu
、Cu 与Fe
与Fe