题目内容
15. T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?X(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是( )
T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?X(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是( )| A. | T℃时,该反应的平衡常数值为4 | |
| B. | c点没有达到平衡,此时反应向逆向进行 | |
| C. | 若c点为平衡点,则此时容器内的温度高于T℃ | |
| D. | T℃时,在d点加入一定量X可达到c点 |
分析 A、平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,固体和纯液体不写入表达式;
B、C点浓度商小于K,反应正向进行;
C、反应是放热反应,若C点为平衡状态,此时平衡常数小于T°C平衡常数,说明平衡逆向进行;
D、X为固体,加入一定量X平衡不移动.
解答 解:A、平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,固体和纯液体不写入表达式,A(g)+B(g)?C(s),平衡常数K=$\frac{1}{c(A)c(B)}$=$\frac{1}{4}$=0.25,故A错误;
B、依据图象分析可知,C点浓度商Q<K,反应正向进行,故B错误;
C、反应是放热反应,若C点为平衡状态,此时平衡常数小于T°C平衡常数,说明平衡逆向进行,是升温的结果,温度高于T°C,故C正确;
D、X为固体,加入一定量X平衡不移动,所以在d点加入一定量X不可达到c点,故D错误;
故选C.
点评 本题考查了化学平衡常数的影响因素分析和计算应用,主要是平衡原理的影响因素分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
6.下列物质属于弱电解质的是( )
| A. | CH3COOH | B. | NaOH | C. | SO2 | D. | NH4Cl |
20.如表为元素周期表中的一部分,列出10种元素在周期表中的位置.用化学符号回答下列各题.
(1)10种元素中,化学性质最不活泼的是Ar.
(2)②③④三种元素形成的离子中,离子半径由大到小的顺序是K+>Ca2+>Mg2+.
(3)①③⑤三种元素最高价氧化物对应的水化物中,碱性最强的是NaOH.
(4)元素⑦的氢化物的化学式为H2O;该氢化物常温下和②单质反应的化学方程式是2K+2H2O=2KOH+H2↑;若该氢化物和元素⑧的单质反应,则化学方程式为Cl2+H2O=HCl+HClO.
(5)⑨的最高价氧化物对应水化物的化学式为HBrO4;①和⑨两元素形成化合物为NaBr;该化合物灼烧时火焰颜色为黄色;该化合物的溶液与元素⑧的单质反应的离子方程式为2Br-+Cl2═2Cl-+Br2.
(6)①和⑤元素最高价氧化物对应水化物相互反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
族 周期 | ||||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)②③④三种元素形成的离子中,离子半径由大到小的顺序是K+>Ca2+>Mg2+.
(3)①③⑤三种元素最高价氧化物对应的水化物中,碱性最强的是NaOH.
(4)元素⑦的氢化物的化学式为H2O;该氢化物常温下和②单质反应的化学方程式是2K+2H2O=2KOH+H2↑;若该氢化物和元素⑧的单质反应,则化学方程式为Cl2+H2O=HCl+HClO.
(5)⑨的最高价氧化物对应水化物的化学式为HBrO4;①和⑨两元素形成化合物为NaBr;该化合物灼烧时火焰颜色为黄色;该化合物的溶液与元素⑧的单质反应的离子方程式为2Br-+Cl2═2Cl-+Br2.
(6)①和⑤元素最高价氧化物对应水化物相互反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
7.下列有关化学能与热能的说法正确的是( )
| A. | 酸与碱发生中和反应所放出的热量称为中和热 | |
| B. | 若某反应的反应物的总能量大于生成物的总能量,则该反应为吸热反应 | |
| C. | H2→H+H的变化需要吸收能量 | |
| D. | 凡经加热而发生的化学反应都是吸热反应 |
4.同主族元素形成的同一类化合物往往在结构和性质上很相似.化合物PH4I是一种白色晶体,则对PH4I的叙述不正确的是( )
| A. | 它可由PH3和HI化合而成 | |
| B. | 加热时PH4I可以分解,而且有颜色变化 | |
| C. | 它可以跟NaOH反应 | |
| D. | 它是一种共价化合物 |

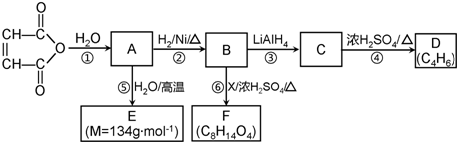

 C2H5OOCCH2CH2COOC2H5+2H2O.
C2H5OOCCH2CH2COOC2H5+2H2O.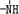 、
、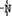 一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为N4H4=NH4++N3-.
一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为N4H4=NH4++N3-.
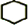 ,名称是环己烷.
,名称是环己烷. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.