题目内容
在一饱和AgCl水溶液(含有AgCl固体)中,添加下列试剂能使c(Cl-)增加的是( )
| A.氨水 | B.硝酸 | C.水 | D.AgNO3 |
A
试题分析:根据沉淀溶解平衡可知:AgCl(s)
 Ag+(aq)+Cl-(aq),加入氨水可以将Ag+转变成Ag(NH3)2+使平衡正向移动,c(Cl-)增加,加入硝酸不影响c(Ag+)和c(Cl-)浓度,平衡不移动,加水,饱和溶液仍为饱和溶液,c(Ag+)和c(Cl-)浓度不变,加AgNO3,c(Ag+)增加c(Cl-)减少。答案选A。
Ag+(aq)+Cl-(aq),加入氨水可以将Ag+转变成Ag(NH3)2+使平衡正向移动,c(Cl-)增加,加入硝酸不影响c(Ag+)和c(Cl-)浓度,平衡不移动,加水,饱和溶液仍为饱和溶液,c(Ag+)和c(Cl-)浓度不变,加AgNO3,c(Ag+)增加c(Cl-)减少。答案选A。点评:改变影响平衡移动的一个因素,平衡总是向减弱这种改变的方向移动。

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
 H++A2- 完成以下问题:
H++A2- 完成以下问题: 2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80%
2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80%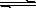 Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。