题目内容
19.下列说法不正确的是( )| A. | 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n | |
| B. | 等质量的烃CxHy完全燃烧耗氧量的多少取决于y/x的值的大小,y/x的值越大,耗氧量越多 | |
| C. | 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减少,则y<4;否则y>4 | |
| D. | 质量相同的两种有机物完全且充分燃烧产生等量的二氧化碳,则这两种有机物中碳元素的质量分数一定相同 |
分析 A.依据质量守恒定律可知该物质中一定含有碳、氢元素,氧元素不能确定;
B.等质量的烃燃烧时,含氢量越大,耗氧越多;
C.根据通式分析CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O;
D.含碳质量分数相同,则等质量时一定含有相同质量的C元素,等质量时完全燃烧产生的二氧化碳质量一定相等.
解答 解:A.依据质量守恒定律可知该物质中一定含有碳、氢元素,氧元素不能确定,可能有可能没有,故A错误;
B.因12gC可与1mol氧气反应,而4g氢气可与1mol氧气反应,则等质量的烃燃烧时,含氢量越大,耗氧越多,故B正确;
C.根据通式分析CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,可知如果反应前后气体体积不变则y=4;若气体体积减少,则y<4;若气体体积增大,则y>4,故C正确;
D.含碳质量分数相同,则等质量时一定含有相同质量的C元素,等质量时完全燃烧产生的二氧化碳质量一定相等,故D正确.
点评 本题考查了有机物的燃烧规律,题目比较简单,注意燃烧通式的写法.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
10.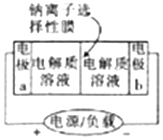 如图是一种正在投入生产的大型蓄电池系统的原理图,电池中的左右两侧为电极,中间为钠离子选择性膜(电池放电和充电时该膜只允许钠离子通过),电池充、放电时反应的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.下列关于此电池的说法正确的是( )
如图是一种正在投入生产的大型蓄电池系统的原理图,电池中的左右两侧为电极,中间为钠离子选择性膜(电池放电和充电时该膜只允许钠离子通过),电池充、放电时反应的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.下列关于此电池的说法正确的是( )
 如图是一种正在投入生产的大型蓄电池系统的原理图,电池中的左右两侧为电极,中间为钠离子选择性膜(电池放电和充电时该膜只允许钠离子通过),电池充、放电时反应的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.下列关于此电池的说法正确的是( )
如图是一种正在投入生产的大型蓄电池系统的原理图,电池中的左右两侧为电极,中间为钠离子选择性膜(电池放电和充电时该膜只允许钠离子通过),电池充、放电时反应的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.下列关于此电池的说法正确的是( )| A. | 电极a接触到的电解质溶液为Na2S2-Na2S4混合溶液 | |
| B. | 放电过程中.钠离子从电极b通过钠离子选择性膜移动到电极a | |
| C. | 电池放电时,负极的电极反应式为3Br--2e-=Br3- | |
| D. | 充电过程中,当有0.1molNa+通过钠离子选择性膜时.导线中通过0.2mol电子 |
14.铁丝与水蒸气反应的产物有( )
| A. | O2 | B. | Fe3O4 | C. | Fe2O3 | D. | FeO |
4.某羧酸酯的分子式为C19H28O5,1mol该酯完全水解可得到羧酸的分子式为( )
| A. | C15H22O5 | B. | C15H20O5 | C. | C15H18O5 | D. | C15H24O5 |
11.常温下,下列各组离子或分子在指定溶液中能大量共存的是( )
| A. | 甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO${\;}_{4}^{2-}$ | |
| B. | c(NaHCO3)=0.1 mol•L-1的溶液中:K+、C6H5O-、SO${\;}_{4}^{2-}$、CO32- | |
| C. | 含有大量Fe2+的溶液:Na+、SO42+、NH4+、Fe(CN)63? | |
| D. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、S2? |

 .
.