题目内容
从海水中提取镁的工艺流程主体是( )
A、海水
| ||||||
B、海水
| ||||||
C、海水
| ||||||
D、海水
|
考点:金属冶炼的一般原理
专题:元素及其化合物
分析:海水中含有镁离子,要想从海水中提取镁,首先要将镁离子转化为难溶性的镁的化合物,镁是活泼金属,所以工业上用电解熔融氯化镁的方法冶炼镁.
解答:
解:海水中含有镁离子,要想从海水中提取镁,首先要将镁离子转化为难溶性的氢氧化镁,所以向海水中加入碱,且加入的碱要廉价,所以可以选取熟石灰制取氢氧化镁;镁是活泼金属,所以工业上用电解熔融氯化镁或氧化镁的方法冶炼,但氧化镁熔点较高,电解时浪费热能,所以一般采用电解熔融氯化镁的方法冶炼,加入熟石灰后生成的氢氧化镁和盐酸反应生成氯化镁,氯化镁溶液在氯化氢氛围中制取无水氯化镁,然后采用电解熔融氯化镁的方法冶炼镁,故选B.
点评:本题考查了镁的提取和冶炼,根据金属的活动性强弱确定冶炼方法,注意冶炼铝时是电解氧化铝而不是氯化铝,为易错点.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、只含有一种元素的物质一定是纯净物 |
| B、石墨转变为金刚石为化学变化 |
| C、水很稳定是因为水分子间存在较强的分子间作用力 |
| D、相对分子质量相同的不同物质一定是同分异构体 |
一溴代烃A经水解后再氧化得到有机物B,A 的一种同分异构体经水解得到有机物C,B和C可发生酯化反应生成酯D,则D 可能是( )
| A、(CH3)2CHCOOCH (CH3)2 |
| B、(CH3)2CHCOOCH(CH3)CH2CH3 |
| C、(CH3)2CHCOOCH2CH(CH3)2 |
| D、CH3(CH2)2COOCH2(CH2)2CH3 |
假设厨房里的食用油不慎混入较多水分,采用下列何种方法可以正确分离( )
| A、过滤 | B、蒸馏 | C、分液 | D、萃取 |
下列说法中正确的是( )
| A、25℃时,向CH3COONa溶液中加入适量CH3COOH使混合液pH=7,此时溶液中C(Na+)=C(CH3COO-) |
| B、25℃时,0.1 mol?L-1氨水和0.05mol?L-氨水中OH-浓度之比是2:1 |
| C、体积相同、pH值相同的①盐酸 ②硫酸 ③醋酸,被NaOH溶液完全中和,消耗NaOH溶液体积由小到大的顺序是②<①<③ |
| D、向含有HCO3-、CH3COO-、CO32-、SO32-离子的溶液中加入足量的Na2O2固体后,假设溶液体积不变,则以上四种离子浓度基本保持不变的是CO32-和CH3COO- |
 某学生利用C、N、O三种原子拼接成了一种新型分子TetranitiBtoxycarbon(结构如图所示),科学家经过研究发现,这种分子具有良好的贮能特性,一旦被合成完全可用于制造新的炸药.下列有关说法正确的是( )
某学生利用C、N、O三种原子拼接成了一种新型分子TetranitiBtoxycarbon(结构如图所示),科学家经过研究发现,这种分子具有良好的贮能特性,一旦被合成完全可用于制造新的炸药.下列有关说法正确的是( )| A、该分子的分子式为CNO3 |
| B、分子中既含极性键又含非极性键 |
| C、C、N的化合价分别为+4、+3 |
| D、该物质为高分子化合物 |
下列有关有机化学实验的说法中,错误的是( )
| A、除去乙醇中少量乙酸:加入足量生石灰蒸馏 |
| B、乙烯和乙醇都能使酸性KMnO4溶液褪色 |
| C、实验室里制备少量乙酸乙酯可用饱和Na2CO3溶液接收生成物 |
| D、分离甘油和氯化钠溶液用分液的方法 |
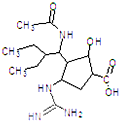 2013年4月5日国家食品药品监督管理局批准了抗H7N9流感新药帕拉米韦氯化钠注射液,帕拉米韦结构如图所示.下列有关说法正确的是( )
2013年4月5日国家食品药品监督管理局批准了抗H7N9流感新药帕拉米韦氯化钠注射液,帕拉米韦结构如图所示.下列有关说法正确的是( )| A、该分子式为C15H28N4O4 |
| B、帕拉米韦能发生取代、加成、消去和氧化反应 |
| C、该分子为难溶于水的药物,遇FeCl3溶液显紫色 |
| D、该分子中含有4种官能团 |



