题目内容
下列说法正确的是( )
| A、任何条件下,纯水的pH都是7 |
| B、95℃纯水中c(H+)<10-7 mol?L-1 |
| C、95℃纯水的pH大于7 |
| D、任何条件下,纯水都显中性 |
考点:水的电离
专题:电离平衡与溶液的pH专题
分析:A、常温纯水PH=7,水电离时吸热过程,升温平衡正向进行,溶液PH减小;
B、水电离时吸热过程,升温平衡正向进行,氢离子浓度增大;
C、水电离时吸热过程,升温平衡正向进行,氢离子浓度增大,PH减小;
D、纯水中氢离子浓度和氢氧根离子浓度相同;
B、水电离时吸热过程,升温平衡正向进行,氢离子浓度增大;
C、水电离时吸热过程,升温平衡正向进行,氢离子浓度增大,PH减小;
D、纯水中氢离子浓度和氢氧根离子浓度相同;
解答:
解:A、常温纯水PH=7,水电离时吸热过程,升温平衡正向进行,溶液PH减小,如100°C,纯水PH=6,故A错误;
B、水电离时吸热过程,升温平衡正向进行,氢离子浓度增大,95℃纯水中c(H+)>10-7 mol?L-1,故B错误;
C、水电离时吸热过程,升温平衡正向进行,氢离子浓度增大,PH减小,95℃纯水的pH小于7,故C错误;
D、纯水中氢离子浓度和氢氧根离子浓度相同,任何条件下,纯水都显中性,故D正确;
故选D.
B、水电离时吸热过程,升温平衡正向进行,氢离子浓度增大,95℃纯水中c(H+)>10-7 mol?L-1,故B错误;
C、水电离时吸热过程,升温平衡正向进行,氢离子浓度增大,PH减小,95℃纯水的pH小于7,故C错误;
D、纯水中氢离子浓度和氢氧根离子浓度相同,任何条件下,纯水都显中性,故D正确;
故选D.
点评:本题考查了水的电离平衡影响因素分析,PH计算分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
能用酸性高锰酸钾溶液鉴别的一组物质是( )
| A、乙烯 乙炔 |
| B、苯 己烷 |
| C、苯 甲苯 |
| D、己烷 环己烷 |
下列化学用语正确的是( )
A、S原子的结构示意图: |
B、氯化钠的电子式: |
| C、乙烯的结构简式:CH2=CH2 |
| D、碳酸钠的电离方程式:NaHCO3=Na++H++CO32- |
能用H++OH-=H2O来表示的化学反应是( )
| A、固体Cu(OH)2和H2SO4溶液反应 |
| B、Ba(OH)2溶液和H2SO4溶液反应 |
| C、KOH溶液和醋酸溶液反应 |
| D、澄清石灰水和HNO3溶液反应 |
在一个的固定容积的密闭容器中,可逆反应:2SO2+O2?2SO3达到平衡的标志是( )
| A、SO2、O2、SO3的浓度之比为 2:1:2 |
| B、SO2、O2、SO3的浓度均不再变化 |
| C、单位时间内消耗1molO2同时生成2molSO3 |
| D、SO2、O2、SO3共存 |
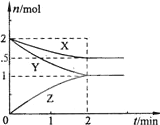 在容器固定的2L密闭容器中,一定条件下,发生如下反应X(g)+2Y(g)?n Z(g),反应过程中各物质的物质的量与时间的关系如图所示,则下列有关叙述中正确的是( )
在容器固定的2L密闭容器中,一定条件下,发生如下反应X(g)+2Y(g)?n Z(g),反应过程中各物质的物质的量与时间的关系如图所示,则下列有关叙述中正确的是( )①n=1 ②n=2 ③反应开始至2min时,Y的转化率为50% ④反应开始至平衡时,Vx=0.75mol?L-1?min-1 ⑤X的平衡浓度为0.75mol?L-1 ⑥达平衡时容器内的压强是开始时的0.875倍.
| A、②③⑤⑥ | B、②④⑤ |
| C、②③④⑥ | D、①③④⑥ |
下列物质能发生消去反应的是( )
| A、CH3I |
| B、CH3OH |
| C、(CH3)3COH |
| D、(CH3)3C-CH2C1 |
化学实验中安全意识是重要的科学素养,下列实验操作正确的是( )
| A、将含硫酸的废液倒入水槽,用水冲入下水道 |
| B、做氢气还原氧化铜实验时,先通氢气再加热 |
| C、配制稀硫酸时,可先在量筒中加一定体积的水,再边搅拌边慢慢加入浓硫酸 |
| D、点燃酒精灯时可以拿燃着的酒精灯引燃另一只酒精灯 |



