题目内容
13.常温下,将下列物质溶于水中分别配制成0.1mol•L-1溶液,所得溶液pH大于7的是( )| A. | NaCl | B. | NaHSO4 | C. | NaHCO3 | D. | CH3COOH |
分析 常温下,0.1mol/L的溶液pH>7,说明该溶液中的溶质是碱或强碱弱酸盐或强碱弱酸酸式盐,据此分析解答.
解答 解:A.NaCl是强碱强酸盐,其水溶液呈中性,常温下pH=7,故A错误;
B.硫酸氢钠是强酸强碱酸式盐,在水溶液中完全电离生成钠离子、氢离子、硫酸根离子而导致溶液呈酸性,pH<7,故B错误;
C.碳酸氢钠是强碱弱酸酸式盐,碳酸氢根离子水解程度大于电离程度而导致其溶液呈碱性,常温下pH>7,故C正确;
D.醋酸是酸,在水溶液中电离出氢离子而导致溶液呈酸性,常温下pH<7,故D错误;
故选C.
点评 本题考查电解质溶液酸碱性判断及电解质的电离,明确物质的性质是解本题关键,知道盐类在水溶液中电离、水解特点,注意硫酸氢钠在水溶液中或熔融状态下电离区别,题目难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
10.关于化学反应中能量变化的说法错误的是( )
| A. | 如图所示的反应为吸热反应 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 需要加热才有发生的反应一定是吸热反应 | |
| D. | 化学键断裂吸收能量,化学键生成放出能量 |
1.向BaCl2溶液中通入某混合气体,无沉淀产生,则该混合气体是( )
| A. | 2molNO和1molCO2 | B. | 1molCO2和2molNH3 | ||
| C. | 1molCl2和lmolSO2 | D. | 1molNO2和lmolSO2 |
8.下列有关化学与自然资源的开发利用描述中错误的是( )
| A. | 用H2作为燃料的优点之一是燃烧后的产物不污染环境 | |
| B. | 要使海水淡化通常有蒸馏法和离子交换法 | |
| C. | 冶炼金属铝通常用电解氯化铝的方法 | |
| D. | 煤的干馏属于化学变化 |
5.下列说法正确的是( )
| A. | 某烷烃的结构为: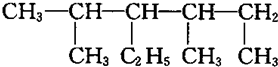 ,正确的命名是3,5-二甲基-4-乙基己烷 ,正确的命名是3,5-二甲基-4-乙基己烷 | |
| B. | 涤纶是由对苯二甲酸(PTA)和乙二醇(EG)通过加聚反应得到的 | |
| C. | 有机物CH3CH2CH(CH3)2的一氯代物有4种 | |
| D. | 有机同系物具有相同的通式,且组成相差若干个“CH2”,因此等质量的同系物燃烧耗氧相差物质的量为1.5nmol |
2. 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断正确的是( )
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断正确的是( )
 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断正确的是( )
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断正确的是( )| A. | Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | 加适量NH4Cl固体可使溶液由a点变到b点 | |
| C. | 对a、b两点的Ksp前者大于后者 | |
| D. | Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |
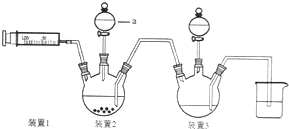 二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,M=250.5g•mol-1,紫红色固体)因在离子鉴定、电镀、医学方面的广泛应用受到了人们的关注,它不溶于乙醇,难溶于水.实验室制备二氯化一氯五氨合钴的流程如下,装置如图:
二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,M=250.5g•mol-1,紫红色固体)因在离子鉴定、电镀、医学方面的广泛应用受到了人们的关注,它不溶于乙醇,难溶于水.实验室制备二氯化一氯五氨合钴的流程如下,装置如图:
 ;元素⑦的原子结构示意图
;元素⑦的原子结构示意图 .
.