题目内容
13.海藻中含有丰富的以离子形式存在的碘元素.下图是实验室从海藻中提取碘的流程的一部分.
下列判断正确的是( )
| A. | 步骤①、③的操作分别是过滤、萃取 | |
| B. | 步骤②的反应是非氧化还原反应 | |
| C. | 步骤③中加入的有机溶剂是裂化汽油或四氯化碳 | |
| D. | 步骤④的操作是过滤 |
分析 实验室从海带中提取碘:海带灼烧成灰,浸泡溶解得到海带灰悬浊液,通过①过滤,得到不溶的残渣,滤液为含碘离子的溶液,加入氧化剂②Cl2,将碘离子氧化成碘单质,利用有机溶剂萃取出碘单质③,再通过蒸馏④提取出碘单质,以此解答该题.
解答 解:A.由以上分析可知步骤①、③的操作分别是过滤、萃取,故A正确;
B.涉及氯气将碘离子氧化为碘单质,属于氧化还原反应,故B错误;
C.裂化汽油含有不饱和烃,与碘发生加成反应,不能用于萃取剂,故C错误;
D.步骤④的操作蒸馏,故D错误.
故选A.
点评 本题考查了海水资源的综合利用,为高频考点,侧重考查学生的分析能力和实验能力,明确物质分离提纯的选取方法、萃取剂的选取标准、每一步发生的反应即可解答,题目难度不大.

练习册系列答案
相关题目
14.下列离子方程式书写正确的是( )
| A. | Cu(OH)2与稀硝酸反应:H++OH-=H2O | |
| B. | 铜片与浓硝酸反应:Cu+4H++2 NO3-=Cu2++2NO2↑+2H2O | |
| C. | 氨水与MgCl2溶液反应:Mg2++2OH-=Mg(OH)2↓ | |
| D. | 铁与稀硝酸反应:Fe+2H+=Fe2++H2↑ |
4.食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧过程与电化学知识相关,下列分析正确的是( )
| A. | 脱氧过程是吸热反应,可降低温度,延长食品保质期 | |
| B. | 脱氧过程中炭作原电池正极,电极反应为4H++O2+4e-═2H2O | |
| C. | 含有0.56g铁粉的脱氧剂,理论上最多能吸收氧气168mL (标准状况) | |
| D. | 该过程实现了电能到化学能的转化 |
1.海洋约占地球表面的71%,具有十分巨大的开发潜力,目前的南海争端威胁到我们国家的核心利益.通过海水资源的开发利用不能得到的是( )
| A. | 石油、天然气 | B. | 乙醇、乙酸 | C. | 淡水 | D. | 钠、钾、镁、溴 |
8.近年来,以煤为原料制备一些化工产品的前景又被看好.如图是以烃A为原料生产人造羊毛的合成路线.下列说法错误的是( )
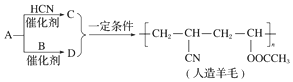

| A. | A生成D的反应属于取代反应 | B. | A生成C的反应属于加成反应 | ||
| C. | 合成人造羊毛的反应属于加聚反应 | D. | 烃A的结构简式为CH≡CH |
5.下列化学反应的能量变化与如图不符合的是( )
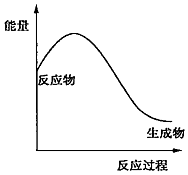

| A. | 2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O | |
| B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| C. | Mg+2HCl=MgCl2+H2↑ | |
| D. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 |
2.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4L苯中含σ键数目为12NA | |
| B. | 常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA | |
| C. | 常温下,1.0L 0.1 mol•L-1 FeCl3溶液中,Fe3+离子数目为0.1NA | |
| D. | O3氧化NO 结合水洗可产生HNO3和O2,每生成1mol HNO3转移的电子数为6NA |
4.下列说法正确的是( )
| A. | 凡是分子组成相差一个或几个“CH2”原子团的物质,一定互为同系物 | |
| B. | 两种化合物的组成元素相同,各元素质量分数也相同,则两者一定互为同分异构体 | |
| C. | 质子数相同,中子数不同的粒子,互为同位素 | |
| D. | 组成元素的质量分数相同,且相对分子质量也相同的不同化合物互为同分异构体 |
 某有机物含C、H、N、O四种元素,下图为该有机物球棍模型.
某有机物含C、H、N、O四种元素,下图为该有机物球棍模型.