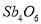题目内容
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.1L0.1mol?L-1的氨水含有0.1 NA个NH4+
B.84gNaHCO3晶体中含有 NA个 HCO3-
C.1 mol Fe在氧气中充分燃烧失去的电子数为3NA
D.64 g铜片与足量稀HNO3反应生成NA个NO分子
B
【解析】
试题分析:A、NH3?H2O为弱碱,部分电离,所以1L0.1mol?L-1的氨水含有NH4+小于0.1 NA,故A错误;B、84gNaHCO3物质的量为1mol,则含NA个 HCO3-,故B正确;C、Fe在氧气中充分燃烧生成Fe3O4,失去电子数为 8/3 NA,故C错误;D、铜与稀硝酸反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,64 g铜为1mol,则生成的NO为2/3mol,分子数目为2/3NA,故D错误。
考点:本题考查阿伏伽德罗常数的计算。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
如下表为元素周期表的一部分,请回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 |
|
|
|
| ① |
| ② |
|
3 |
| ③ | ④ | ⑤ |
| ⑥ | ⑦ | ⑧ |
4 | ⑨ |
|
|
|
|
| ⑩ |
|
(1)⑤和⑧的元素符号是________和________。
(2)表中最活泼的金属是________,非金属性最强的元素是________(填写元素符号)。
(3)表中能形成两性氢氧化物的元素是________,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物对应的水化物反应的化学方程式________________、_______________________。
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:_____________________________。

 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
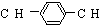 ,则M的结构式共有
,则M的结构式共有 
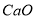 生成的沉淀是_______,若通入的气体A少量则反应2的离子方程式为_____________。
生成的沉淀是_______,若通入的气体A少量则反应2的离子方程式为_____________。 Sb4O6+6FeS②Sb4O6+6C
Sb4O6+6FeS②Sb4O6+6C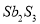 、
、