题目内容
15.下列说法错误的是( )| A. | 葡萄糖可用于合成葡萄糖到钙口服液 | |
| B. | 工业制普通玻璃的原料是石英、纯碱、石灰石 | |
| C. | 月饼包装盒中常放入生石灰或硅胶做干燥剂,铁粉或硫酸亚铁做抗氧化剂 | |
| D. | 原子利用率=期望产物的原子总数与生成物原子总数之比 |
分析 A.葡萄糖可用于合成葡萄糖酸钙;
B.依据生产玻璃的原料解答;
C.生石灰或硅胶具有吸水性,铁粉或硫酸亚铁具有还原性;
D.原子利用率=期望产物的总质量与生成物的总质量之比.
解答 解:A.葡萄糖酸钙常被用做补钙剂,故A正确;
B.生产玻璃的原料是纯碱、石灰石和石英,故B正确;
C.饼包装盒中常放入生石灰或硅胶做干燥剂,铁粉或硫酸亚铁做抗氧化剂,故C正确;
D.原子利用率=期望产物的总质量与生成物的总质量之比,故D错误;
故选:D.
点评 本题考查了元素化合物知识,熟悉相关物质的性质和用途、明确生产玻璃的原料、原子利用率概念是解题关键,题目难度不大.

练习册系列答案
相关题目
14.可用于鉴别以下三种化合物的试剂组合是( )
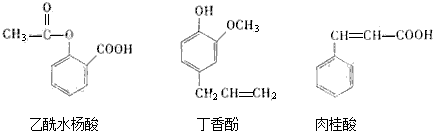
①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④碳酸钠溶液.

①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④碳酸钠溶液.
| A. | ②与③ | B. | ③与④ | C. | ①与④ | D. | ②与④ |
6.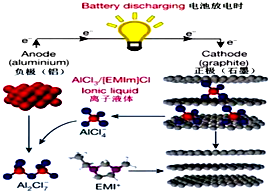 据2015年4月10日的报道,湖南大学 85后副教授鲁兵安参与斯坦福大学的团队刚刚发明出了一种“一分钟充满电”的新型铝离子电池.他们发现了一种新型石墨材料--泡沫石墨(graphite foam),泡沫石墨刚好可以充当电池的正极(负极用铝制成),而电解液则采用一种离子液体--即全由离子组成、室温下呈液态的离子化合物,具体成分为一种有机盐(化学表达式为[EMIm]Cl)与氯化铝的混合物.如图:关于该电池的说法不正确的是( )
据2015年4月10日的报道,湖南大学 85后副教授鲁兵安参与斯坦福大学的团队刚刚发明出了一种“一分钟充满电”的新型铝离子电池.他们发现了一种新型石墨材料--泡沫石墨(graphite foam),泡沫石墨刚好可以充当电池的正极(负极用铝制成),而电解液则采用一种离子液体--即全由离子组成、室温下呈液态的离子化合物,具体成分为一种有机盐(化学表达式为[EMIm]Cl)与氯化铝的混合物.如图:关于该电池的说法不正确的是( )
 据2015年4月10日的报道,湖南大学 85后副教授鲁兵安参与斯坦福大学的团队刚刚发明出了一种“一分钟充满电”的新型铝离子电池.他们发现了一种新型石墨材料--泡沫石墨(graphite foam),泡沫石墨刚好可以充当电池的正极(负极用铝制成),而电解液则采用一种离子液体--即全由离子组成、室温下呈液态的离子化合物,具体成分为一种有机盐(化学表达式为[EMIm]Cl)与氯化铝的混合物.如图:关于该电池的说法不正确的是( )
据2015年4月10日的报道,湖南大学 85后副教授鲁兵安参与斯坦福大学的团队刚刚发明出了一种“一分钟充满电”的新型铝离子电池.他们发现了一种新型石墨材料--泡沫石墨(graphite foam),泡沫石墨刚好可以充当电池的正极(负极用铝制成),而电解液则采用一种离子液体--即全由离子组成、室温下呈液态的离子化合物,具体成分为一种有机盐(化学表达式为[EMIm]Cl)与氯化铝的混合物.如图:关于该电池的说法不正确的是( )| A. | 放电时,铝电极的电极反应式为:Al+7AlCl4--3e-═4Al2Cl7- | |
| B. | [EMIm]Cl中既含离子键,又含共价键 | |
| C. | 电子流向为:石墨通过离子液体流向铝 | |
| D. | 充电时石墨电极的电极反应式为:Cn[AlCl4]-e-═Cn+AlCl4- |
3.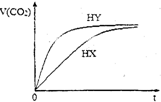 25℃时,将浓度均为0.1mol•L-1HX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )
25℃时,将浓度均为0.1mol•L-1HX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )
 25℃时,将浓度均为0.1mol•L-1HX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )
25℃时,将浓度均为0.1mol•L-1HX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )| A. | 相同浓度的HX和HY溶液中水的电离程度:HX>HY | |
| B. | 相同体积相同浓度的HX和HY溶液中阴离子数目前者大于后者 | |
| C. | 向10mL 0.1mol•L-1的Na2CO3溶液中缓慢滴加10mL0.1mol•L-1的HY,混合后的离子浓度大小关系: c (Na+)>c (Y-)>c(HCO3-)>c (OH-)>c(H+) | |
| D. | 将等体积等浓度的HX和HY溶液分别用相同浓度的氢氧化钠溶液滴定,至中性时,消耗的氢氧化钠溶液体积前者大于后者 |
10.“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是( )
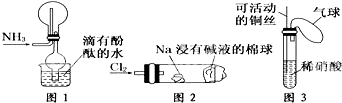
①实验室收集氨气采用图1所示装置
②实验室中做氯气与钠反应实验时采用图2所示装置
③实验室中采用图3所示装置进行铜与稀硝酸的反应
④实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验.

①实验室收集氨气采用图1所示装置
②实验室中做氯气与钠反应实验时采用图2所示装置
③实验室中采用图3所示装置进行铜与稀硝酸的反应
④实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验.
| A. | ②③④ | B. | ①②④ | C. | ①②③ | D. | ①③④ |
20.Ⅰ.Fe3+具有氧化性,实验室测定含碘废液中I-的含量的过程如下:量取25.00mL废液于250mL锥形瓶中,分别加入5mL 2mol•L-1 H2SO4和10mL 20% Fe2(SO4)3溶液,摇匀.小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入几滴二苯胺磺酸钠(用作指示剂),用0.02500mol•L-1标准K2Cr2O7溶液进行滴定到终点.重复3次,数据记录如表:
(1)在盛有废液的锥形瓶中先加入5mL 2mol•L-1 H2SO4的目的是Fe3++3H2O?Fe(OH)3+3H+,加入H2SO4平衡逆向移动,抑制Fe3+水解.(用离子方程式和语言叙述解释)
(2)上述过程中涉及的反应:①2Fe3++2I-═2Fe2++I2②6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)根据滴定有关数据,该废液中I-含量是15.24g•L-1.
(4)在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是A.
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗衣后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡.
Ⅱ.Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点.某学习小组同学设计如下实验:
请回答:
(5)设计实验①的目的是排除NO3-的干扰.
(6)实验③可得出结论是Fe3+能氧化Ag.
(7)写出实验②中反应的离子方程式Fe2++Ag+?Fe3++Ag.
(8)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子浓度有关.
| 次数 | 1 | 2 | 3 |
| 滴定体积/mL | 19.98 | 20.02 | 19.00 |
(2)上述过程中涉及的反应:①2Fe3++2I-═2Fe2++I2②6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)根据滴定有关数据,该废液中I-含量是15.24g•L-1.
(4)在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是A.
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗衣后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡.
Ⅱ.Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点.某学习小组同学设计如下实验:
| 实验编号 | 实验操作 | 现象 |
| 1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 无白色沉淀生成 |
| 2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液 | 紫红色不褪去 |
| 3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 有白色沉淀生成 |
(5)设计实验①的目的是排除NO3-的干扰.
(6)实验③可得出结论是Fe3+能氧化Ag.
(7)写出实验②中反应的离子方程式Fe2++Ag+?Fe3++Ag.
(8)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子浓度有关.
7.塑化剂(DCHP)常用于塑料加工,其中一种制备方法如下:
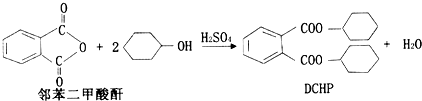
下列说法正确的是( )

下列说法正确的是( )
| A. | DCHP的分子式为C20H28O4 | |
| B. | 上述制备DCHP的反应属于取代反应 | |
| C. | DCHP苯环上的一氯代物有4种 | |
| D. | 1molDCHP最多可与含4molNaOH的溶液反应 |
4.室温下甲为NaX溶液、乙为NaY溶液,两者均为一元酸的钠盐.下列分析正确的是( )
| A. | 等浓度时,若溶液中c(X-)=c(Y-)+c(HY),则乙的pH大 | |
| B. | 等浓度时,若甲的pH大,则甲中总离子浓度大 | |
| C. | 甲浓度大时,若溶液中c(X-)=c(Y-),则甲中水的电离程度大 | |
| D. | 乙浓度大时,若酸性HX强,则乙的水解程度大 |
5.下列物质属于碱的是( )
| A. | 苛性钠 | B. | 生石灰 | C. | 纯碱 | D. | 胆矾 |