题目内容
【题目】将10 mol H2和5 mol N2放入10 L真空密闭容器内,一定温度下发生如下反应:3H2(g)+N2(g) ![]() 2NH3(g),在最初的0.2 s内,消耗H2的平均速率为0.06 mol·L1·s1,则在0.2 s末,容器中NH3的物质的量是
2NH3(g),在最初的0.2 s内,消耗H2的平均速率为0.06 mol·L1·s1,则在0.2 s末,容器中NH3的物质的量是
A. 0.12 molB. 0.08 molC. 0.04 molD. 0.8 mol
【答案】B
【解析】
根据v=![]() =
=![]() 可知,△n=v×△t×V,据此分析解答。
可知,△n=v×△t×V,据此分析解答。
根据反应速率之比=化学计量数之比,消耗H2的平均反应速率为0.06 mol·L1·s1,因此生成氨气的平均反应速率为![]() ×0.06 mol·L1·s1=0.04 mol·L1·s1,则△c(NH3)=v×△t=0.04 mol·L1·s1×0.2 s=0.008 mol·L1,容器中NH3的物质的量=0.008 mol·L1×10 L=0.08 mol,故选B。
×0.06 mol·L1·s1=0.04 mol·L1·s1,则△c(NH3)=v×△t=0.04 mol·L1·s1×0.2 s=0.008 mol·L1,容器中NH3的物质的量=0.008 mol·L1×10 L=0.08 mol,故选B。

【题目】工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
(1)已知CO(g)、H2(g)的标准燃烧热分别为 △H=-283kJmol-1, △H=-286kJmol-1,且CH3OH(g)+3/2O2(g) ![]() CO2(g)+2H2O(l) △H=-761kJmol-1;则CO(g)+ 2H2(g)
CO2(g)+2H2O(l) △H=-761kJmol-1;则CO(g)+ 2H2(g)![]() CH3OH(g)的△H= ___________。
CH3OH(g)的△H= ___________。
(2)为了提高CO和H2制备甲醇生产效率和产量;工业生产中通常采取的措施是___________________________________________。(写出两点)
(3)实验室模拟用CO和H2反应来制甲醇,在250 ℃下,将一定量的CO和H2投入10 L的密闭容器中,各物质的物质的量浓度(mol·L-1)变化如下表所示:
2 min | 4 min | 6 min | |
CO | 0.07 | 0.05 | 0.05 |
H2 | x | 0.10 | 0.10 |
CH3OH | 0.03 | 0.05 | 0.05 |
①250 ℃时,该反应的平衡常数K=___________;
②在图1中画出反应开始至第6 min时H2的物质的量的变化曲线,并标出合适的纵坐标。_______
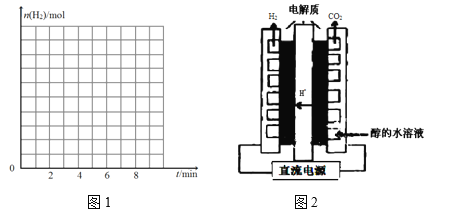
(4)利用电解甲醇水溶液制备氢气最大的优点就是需要的电压低,装置如图2,写出 阳极电极反应方程式____________________________________________________,电解的总反应化学方程式__________________________________________。





